
题目列表(包括答案和解析)
9.(2009·苏州模拟)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价含砷化合物。下列说法中不正确的是( )
A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.上述过程中+5价砷类物质做氧化剂
D.1 mol+5价砷完全转化为+3价砷,共失去2 mol电子
解析:1 mol+5价砷完全转化为+3价砷共得到2 mol电子。
答案:D
8.常温下,加水冲稀时c(H+)/c(OH-)的值明显减小的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO、CH3COO- ②K+、Fe2+、I-、SO ③Ba2+、Cl-、NO、Na+ ④Na+、Ca2+、Cl-、HCO ⑤K+、SO、Cl-、NO
A.②③ B.①③⑤
C.②④ D.②③⑤
解析:加水冲稀时c(H+)/c(OH)-的值明显减小,说明溶液呈酸性,即每组添上氢离子,只有A选项符合。
答案:A
7.(2009·海淀模拟)氰氨基化钙是一种重要的化工原料,制备CaCN2的化学方程式为CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑。在该反应中( )
A.氢元素被氧化,碳元素被还原
B.HCN是氧化剂
C.CaCN2是氧化产物,H2为还原产物
D.CO为氧化产物,H2为还原产物
解析:本题化学反应中元素的化合价变化如下:CaCO3+2N===CaN2+CO↑+2↑+CO2↑,注意到生成物CO2中的碳元素来自CaCO3,其化合价在反应前后未发生变化。根据化合价的变化可知,HCN既是氧化剂又是还原剂,CaCN2是氧化产物,H2是还原产物。
答案:C
6.(2009·深圳五校高三联考)下列有关物质的分类或归类正确的是( )
①混合物:石炭酸、福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡
④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同位素:C、C、C
A.①③④ B.③⑤
C.②③④ D.②④
解析:①石炭酸为苯酚的俗称,属于化合物,水银为汞的俗称,属于单质;②中聚苯乙烯为高分子化合物,属于混合物,HD属于单质;④中CH2O2为甲酸,而C2H4O2、C3H6O2、C4H8O2既可能为羧酸,又可能为酯类。
答案:B
5.(2009·江苏启东中学调研)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH、Cl-、Mg2+、Ba2+、CO、SO,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A.K+一定存在
B.100 mL溶液中含0.01 mol CO
C.Cl-一定不存在
D.Ba2+一定不存在,Mg2+可能存在
解析:由步骤(1)可知,Cl-、CO、SO三者中至少有一种;由步骤(2)可知,一定有NH且可算出有NH0.04 mol;由步骤(3)可知,同时有CO、SO,且可算出有SO0.01 mol,有CO0.02 mol,考虑到离子共存问题,可知原溶液中无Mg2+、Ba2+;考虑到电荷守恒,可知阳离子除了NH外必定还有K+,可能存在Cl-。
答案:A
4.(2009·洛阳)三聚氰胺[C3N3(NH2)3]是一种重要的有机化工原料。动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌,它遇强酸或强碱水溶液会水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2,其反应原理为:C3N3(OH)33HNCO;8HNCO+6NO27N2+8CO2+4H2O,下列说法正确的是( )
A.C3N3(OH)3与HNCO为同一种物质
B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中得到的电子为4 mol
D.反应中CO2是氧化产物
解析:C3N3(OH)3与HNCO的组成不同,结构不同,不是同一种物质,A项错误;由原子成键规律可知HNCO的结构为H-N===C===O,可知其中N显-3价,C显+4价。则氧化还原反应可表示为:

8HCO+624e-O2===7N2+8CO2+4H2O。,HNCO为还原剂,NO2为氧化剂,B项错误;1 mol NO2在反应中转移的电子为4 mol,C项正确;CO2既不是氧化产物,也不是还原产物,D项错误。
答案:C
3.(2009·山西康杰中学)已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO→Mn2+;Cl2→2Cl-;HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.Fe3+ B.MnO
C.Cl2 D.HNO2
解析:选项中等物质的量的各物质得电子数越多,则氧化生成的I2越多。设各取1 mol物质,则Fe3+→Fe2+得1 mol e-,MnO→Mn2+得5 mol e-,Cl2→2Cl-得2 mol e-,HNO2→NO得1 mol e-,故反应中得到I2最多的为MnO。
答案:B
2.(2009·安徽师大附中)下列离子方程式书写正确的是( )
A.在氨水中通入过量SO2:2NH3·H2O+SO2===2NH+SO+H2O
B.在次氯酸钠溶液中通入少量SO2:2ClO-+H2O+SO2===2HClO+SO
C.在氢氧化钠溶液中通入一定量的CO2:3OH-+2CO2===CO+HCO+H2O
D.在硫酸铝溶液中加入过量氨水:Al3++4OH-===AlO+2H2O
解析:氨水中通入过量SO2,生成HSO,A项错误;次氯酸钠溶液中通入少量SO2,SO2会被HClO氧化为SO:ClO-+SO2+H2O===2H++Cl-+SO,B项错误;当≥2时,产物仅为Na2CO3,当≤1时,产物仅为NaHCO3,当1<<2时,产物为Na2CO3、NaHCO3,反应中OH-与CO2的物质的量之比为,所以产物中既有CO又有HCO,C项正确;氢氧化铝不溶于弱酸弱碱,故硫酸铝溶液中加入过量氨水,离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH,D项错误。
答案:C
1.(2009·平顶山许昌联考)一化学兴趣小组在家中进行化学实验,按照图甲连接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )

A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
解析:电解质是指在熔融状态或水溶液中能导电的化合物,NaCl是电解质,其固体无自由移动的离子,不导电,A项错误;NaCl溶液是混合物,不是电解质,也不是非电解质,B项错误;NaCl在水溶液中电离出自由移动的离子,故连接好电路后能导电,C项正确;在NaCl溶液中,水电离出的离子是少量的,D项错误。
答案:C
23.下图是元素周期表中第一、二周期中10种元素的某种性质的一组数据(数据单位相同)。带“……”的四种元素除外,其余元素都给出了该种元素的全部数据。
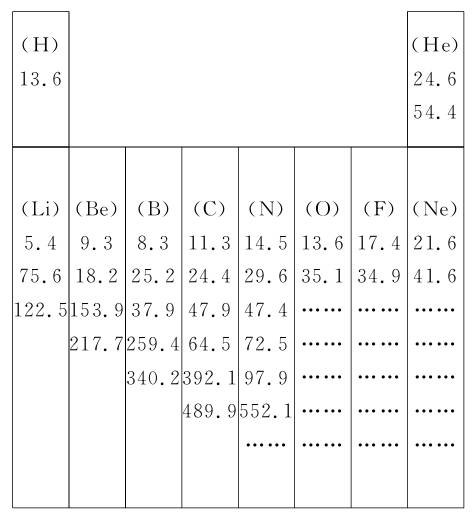
(1)每组数据可能是该元素的__________。
A.原子得到电子所放出的能量
B.单质在不同条件下的熔、沸点
C.原子逐个失去电子所吸收的能量
D.原子及其形成的不同分子的半径大小
(2)稀有气体元素的第一个数据较大的原因是____________________________。
(3)请你推测:Mg和Al的第一个数据的大小:Mg__________Al;S和Cl的第一个数据的大小:S__________Cl。(填“>”或“<”)
(4)同一元素原子的一组数据中,有的数据增大特别多,形成突跃,这些数据出现的规律说明原子结构中____________________________。
答案:(1)C (2)稀有气体元素原子的最外层电子排布已达到8电子(He为2电子)的相对稳定结构,较难失去电子 (3)> < (4)原子核外电子是分层排布的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com