
题目列表(包括答案和解析)
19.新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,其均显+2价,下同),由铁酸盐MFe2O4经高温还原得到,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如下:
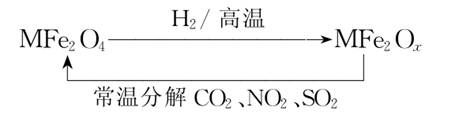
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4 与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=________,MFe2Ox中+2价铁与+3价铁的物质的量之比为________。
(2)在酸性溶液中,Fe2O易转化为Fe2+:
Fe2O+2e-+8H+===2Fe2++4H2O
有K2MnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平:__________________________。
解析:(1)MFe2O4被还原时,MFe2O4与H2的物质的量之比为2∶1,根据得失电子守恒,则(3-)×2×2=2,x=3.5,即Fe在MFe2Ox的平均价态为+2.5价,则Fe2+和Fe3+物质的量之比为1∶1。
(2)要使Fe2O被还原,应选择具有还原性的物质,只能是Cu2O,反应的方程式为:
Fe2O+Cu2O+10H+===2Fe2++2Cu2++5H2O。
答案:(1)3.5 1∶1
(2)Fe2O+Cu2O+10H+===2Fe2++2Cu2++5H2O
18.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是( )

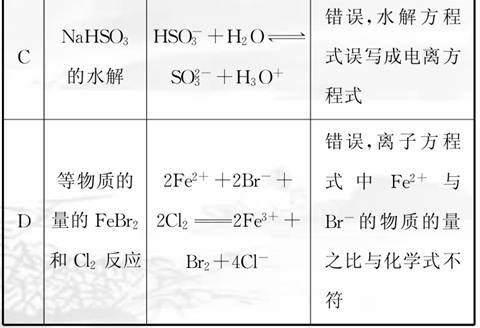
解析:选项A中碳酸钙是强电解质,但是难溶物,在离子方程式中应保留化学式。选项B中由于酸性H2CO3>苯酚>HCO,因此在苯酚钠溶液中不管通入多少CO2气体,生成物中都不可能有CO。选项D中由于通入的Cl2量不足,不能把Br-全部氧化,离子方程式符合质量守恒和电荷守恒,是正确的,但评价错误。
答案:C
第Ⅱ卷(非选择题,共46分)
17.已知酸性条件下有如下反应:2Cu+===Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。某同学对氢气还原氧化铜实验所得的红色固体产物进行验证,每一次实验操作和实验现象记录如下,由此推出氢气还原氧化铜实验的产物是( )
|
加入试剂 |
稀硫酸 |
浓硫酸 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
产生红色固体, 溶液呈 蓝色 |
加热, 产生无色气体 |
产生无 色气体, 溶液呈 蓝色 |
产生红棕色气 体,溶 液呈绿 色 |
A.只有Cu
B.只有Cu2O
C.一定有Cu,可能有Cu2O
D.一定有Cu2O,可能有Cu
解析:根据与稀硫酸反应的现象,说明红色固体产物中一定有Cu2O,是否含有Cu不能确定。
答案:D
16.(2009·合肥市测试)据最新报道,科学家发现了如下反应:O2+PtF6===O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是( )
A.在此反应中,O2是氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6)则转移1 mol 电子
D.在O2(PtF2)中不存在共价键
解析:由题知O2(PtF6)中Pt为+5价,F只有-1价,所以O为+价,在化学反应中O元素化合价升高做还原剂,PtF6是氧化剂,电子转移数目为e-;O中存在着共价键,所以D不正确。
答案:C
15.(2009·上海七宝中学模拟)向X的溶液中加入Y试剂,产生的沉淀示意图与下图所示情形吻合的是(注意线段的斜率)( )
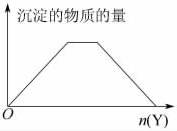
A.向NaOH和Ca(OH)2的混合溶液中通入CO2
B.向HCl和AlCl3的混合溶液中滴加NaOH
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NH4Cl和MgCl2的混合溶液中滴加NaOH
解析:题目中已强调“注意线段的斜率”这句话,所以更应明确图像表示的是一个等腰梯形,而非斜梯形。选项B中滴加的NaOH溶液应先和HCl反应,所以一开始没有沉淀生成,不合题意。选项C中发生的反应依次是:Al3++3OH-===Al(OH)3↓,NH+OH-===NH3·H2O,Al(OH)3+OH-===AlO+2H2O,所得的图形是一个斜梯形。选项D中生成的Mg(OH)2沉淀不溶于NaOH,因此沉淀量不会减少。选项A中,从化学原理分析,反应分为三个阶段:第一阶段是Ca2++2OH-+CO2===CaCO3↓+H2O;第二阶段是2OH-+CO2===CO+H2O(若认为有下列反应发生:CaCO3+H2O+CO2===Ca2++2HCO,由于有OH- 的存在,则有反应Ca2++2HCO+2OH-===CaCO3↓+2H2O+CO,随之发生,这相当于CaCO3没有溶解);第三阶段是CaCO3的溶解过程:CaCO3+H2O+CO2===Ca2++2HCO。
答案:A
14.用48 mL 0.1 mol/L的 FeSO4溶液,恰好还原2.4×10-3 mol [RO(OH)2]+,则R元素的最终价态为( )
A.+2价 B.+3价
C.+4价 D.+5价
解析:由题意可知,发生化合价变化的元素分别为铁元素和R元素。首先根据化学式中正负化合价代数和为零,算出[RO(OH)2]+中R的化合价为+5价。再设R元素的最终价态为x,由电子守恒有:48×10-3L×0.1 mol/L×(3-2)=2.4×10-3mol×(5-x),解得x=3。
答案:B
13.与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关粒子氧化、还原能力的比较中,正确的是( )
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+<Sn2+ D.还原能力:Fe<Sn
解析:据条件可写出化学反应方程式:
①Sn+2HCl===SnCl2+H2↑,
②SnCl2+2FeCl3===2FeCl2+SnCl4。
由此可判断出:氧化能力Fe3+>Sn4+>Sn2+,还原能力Fe>Sn>Sn2+>Fe2+,故只有C正确。
答案:C
12.下列化学反应的离子方程式正确的是( )
A.在稀氨水中通入过量CO2:NH3·H2O+CO2===NH+HCO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO===CaSO4↓+H2O
解析:HClO有强氧化性,可把SO氧化为SO,B错;稀HNO3有氧化性,可把S2-与Fe2+氧化,C错;D应为Ca2++2OH-+2H++SO===CaSO4↓+2H2O,所以D错。
答案:A
11.能正确表示下列反应的离子方程式的是( )
A.足量硫酸铝与纯碱反应:2Al3++3CO+3H2O===2Al(OH)3↓+3CO2↑
B.硫酸铜与烧碱反应:CuSO4+2OH-===Cu(OH)2↓+SO
C.苯酚与碳酸钠反应:2C6H5OH+CO===2C6H5O-+CO2↑+H2O
D.碳酸钡与硫酸反应:Ba2++SO===BaSO4↓
解析:B中CuSO4应以离子形式存在;苯酚的酸性比碳酸的酸性弱,苯酚与Na2CO3反应不可能生成CO2,C错误;D中BaCO3难溶于水,不能以离子形式存在,且也应有气体放出,D错误。
答案:A
10.下列关于物质分类的正确组合是( )
|
分类 组合 |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
|
A |
纯碱 |
盐酸 |
烧碱 |
氧化铝 |
二氧化碳 |
|
B |
烧碱 |
硫酸 |
食盐 |
氧化镁 |
一氧化碳 |
|
C |
苛性钠 |
醋酸 |
碳酸铵 |
过氧化钠 |
二氧化硫 |
|
D |
苛性钾 |
油酸 |
小苏打 |
氧化钠 |
三氧化硫 |
解析:A项中纯碱属盐类,烧碱属碱类,Al2O3属两性氧化物;B项中CO属不成盐氧化物;C项中碳酸铵由NH和CO构成,属盐类,Na2O2属过氧化物,不属碱性氧化物。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com