
题目列表(包括答案和解析)
12、向足量H2SO4溶液中加入100ml 0.4 mol/L Ba(OH) 2溶液,放出的热量是5.12kJ。如果向足量Ba(OH) 2溶液中加入100ml 0.4 mol/L HCl溶液时,放出热量2.2 kJ。则溶液与溶液反应的热化学方程式为( )
A、Ba2+(aq)+SO42-(aq)==BaSO4(s);△H =---2.92 kJ/mol
B、Ba2+(aq)+SO42-(aq)==BaSO4(s);△H = ---0.72 kJ/mol
C、Ba2+(aq)+SO42-(aq)==BaSO4(s);△H = --73 kJ/mol
D、Ba2+(aq)+SO42-(aq)==BaSO4(s);△H = --18kJ/mol
10、 国际奥委会公布的违禁药物目前有一百多种,某种兴奋剂的结构如图,关于它的说法正确的是 ( )
国际奥委会公布的违禁药物目前有一百多种,某种兴奋剂的结构如图,关于它的说法正确的是 ( )
A、该物质是芳香烃
B、它的分子中所有碳原子共平面
C、1mol该物质最多能与2mol氢氧化钠反应
D、1mol该物最多能与4molH2发生加成反应
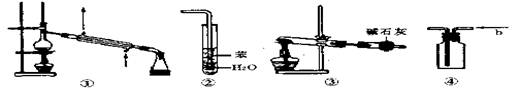 11、实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( ) ( )
11、实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( ) ( )
A、装置①常用于分离沸点不同的液体混合物
B、装置②可用于吸收HCl气体,并防止倒吸
C、以NH4Cl为原料,装置③可用于实验室制备少量NH3
D、装置④由b口进气可收集CO2、NO等气体
9、下列离子方程式正确的是( )
A、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-==BaCO3↓ +H2O
B、钢铁在潮湿的环境下发生吸氧腐蚀的正极反应:O2+4 e-==2O2-
C、足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2==3 Fe3++2Br2+6 Cl-
D、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 ↓+2HClO
8、有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六中粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A、该过程中氧化剂与还原剂的物质的量之比为1:8
B、该过程说明Fe(NO3)2 溶液不宜加酸酸化
C、若有1mol NO3- 发生氧化反应,则转移8mole-
D、若把该反应设计为原电池,则负极反应为Fe2+-e- === Fe3+
7、用NA表示阿伏伽德罗常数,下列叙述正确的是( )
A、将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B、标准状况下,22.4LSO3含有的分子数为NA
C、1mol二氧化硅中含有的Si--O键数目为2NA
D、29克醛基所含的电子数目为15NA
6、化学与科学、技术、社会、环境密切相关,下列有关说法中不正确的是( )
A、食用的蛋白质、淀粉和脂肪都可以发生水解反应
B、大力开发和应用氢能源,有利于实现“低碳经济”
C、海轮外壳上镶入铅块,可以减缓船体的腐蚀速率
D、肥皂的有效成分是经皂化反应生成的高级脂肪酸钠
22.亚铁是血红蛋白的重要组成成分,人如果缺铁就可能出现缺铁性贫血。下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%-36%,是薄衣片……与Vc(维生素C)同服可增加本品吸收。
某同学设计实验对其中的铁成分进行了验证,请一起完成该实验。
(1)查阅资料得知,双氧水既可以氧化SCN-生成N2、CO2和SO,也可以将Fe2+氧化成Fe3+。
(2)向去掉糖衣、研磨好的药品中加稀盐酸,得到浅绿色浑浊液,说明有______(填离子符号)存在。
(3)往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+存在。该离子存在的原因可能是________(填字母)。
a.药品中的铁本来就是以三价铁的形式存在
b.在制药过程中生成少量三价铁
c.本实验过程中有少量二价铁被氧化为三价铁
(4)将(3)中所得溶液分成2份,分别装在A、B 2支试管中。
(5)向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去。红色变深的原因是____________________________________________(用离子方程式表示)。
(6)向B试管的溶液中加入一片Vc片,片刻后溶液红色也褪去,说明Vc有________性。
答案:(2)Fe2+ (3)ac (5)2H++2Fe2++H2O2===2Fe3++2H2O;
11H2O2+2SCN-===N2↑+2CO2↑+2SO+2H++10H2O
(6)还原
0.(4)ABD (5)4 mol
21.某研究性学习小组为了验证臭氧的氧化性强于氧气,进行了下述实验,请参与探究并回答相关问题。
[实验目的]验证臭氧的氧化性强于氧气。
[实验原理]2KI+O3+H2O===2KOH+I2+O2,淀粉溶液遇单质碘变蓝色。
[实验用品]臭氧消毒碗柜、a溶液、碘化钾溶液、滤纸、玻璃片、温度计。
[实验步骤]
①取a溶液与碘化钾溶液混合。
②取两片用滤纸剪成的纸条,在a和碘化钾的混合液中湿润后分别置于两块洁净的玻璃片上。
③将一块玻璃片(Ⅰ)置于臭氧消毒碗柜中并接通电源生成臭氧。将另一块玻璃片(Ⅱ)置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
|
时间(min) |
0 |
15 |
30 |
45 |
60 |
90 |
120 |
|
|
滤纸的 颜色变化 |
玻璃片(Ⅰ)上的滤纸 |
白色 |
白色 |
灰色 |
浅蓝色 |
蓝色 |
蓝色 |
浅蓝色 |
|
玻璃片(Ⅱ) 上的滤纸 |
白色 |
白色 |
白色 |
白色 |
灰色 |
灰色 |
浅蓝色 |
请根据上述实验原理、步骤及你所学的知识,回答下列问题:
(1)实验药品中的a溶液是__________溶液。
(2)写出在臭氧消毒柜中产生O3的化学方程式:______________________________。
(3)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是______________________。
(4)从实验数据记录可以得出的结论是__________(填序号)。
A.O3的氧化性比O2强
B.氧气也能氧化碘化钾中的碘离子
C.空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的
D.O3不仅氧化I-的速率比氧气快,而且有漂白作用
(5)在O3氧化KI的反应中,若有9.6 g O3发生反应,则转移的电子的物质的量为__________。
答案:(1)淀粉 (2)3O2通电2O3
(3)温度会影响反应速率,保持温度相同是为了消除温度不同带来的误差
20.(2009·黄冈秋季期末)A、B、C、D四种可溶化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-SO、CO两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液白色沉淀沉淀不溶解
C溶液白色沉淀沉淀不溶解
D溶液白色溶淀沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:A________;B________;C________;D________。
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式为__________________________。
(3)③中若是向C溶液中滴入D溶液,可能出现的实验现象是______________。
解析:分析4种阳离子和4种阴离子之间的关系可知CO只能与Na+结合成Na2CO3,而OH-只能与Ba2+结合成Ba(OH)2。对照实验②可知A为Ba(OH)2,生成的白色沉淀分别是BaCO3、Mg(OH)2、Al(OH)3、BaSO4,D溶液中生成的白色淀淀再加Ba(OH)2溶液后沉淀部分溶解,说明D是Al2(SO4)3。溶液B可能是Na2CO3或MgCl2。根据实验③可确定溶液B是MgCl2,则C是Na2CO3。(2)中沉淀部分溶解属于铝盐的性质。(3)中CO与Al3+发生双水解反应生成气体和沉淀。
答案:(1)Ba(OH)2 MgCl2 Na2CO3 Al2(SO4)3
(2)Al(OH)3+OH-===AlO+2H2O
(3)冒出大量气泡,同时生成白色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com