
题目列表(包括答案和解析)
10.现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请完成下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为___________________。
(2)电解之前食盐水需要精制,目的是除去精盐中Ca2+、Mg2+、 等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为_________________(填试剂序号)。
等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为_________________(填试剂序号)。
(3)如果在容积为10 L的离子交换膜电解槽中,1 min时阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)____________________________________。
解析:在正确书写电解反应方程式的基础上,关键是把握电解过程中的等量关系,然后进行综合处理,便可解决。
由2NaCl+2H2O 2NaOH+H2↑+Cl2↑,可知n(NaOH)=2n(H2)=2×
2NaOH+H2↑+Cl2↑,可知n(NaOH)=2n(H2)=2×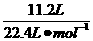 =1 mol,
=1 mol,
c(OH-)=0.1 mol·L-1,故溶液的pH=13。
答案:(1)2Cl--2e-====Cl2↑ (2)b、a、c (3)13
9.某课外化学兴趣小组设计了如图11-3所示装置(虚框内部分未画出),在装置内起初发生的反应为:Cu+H2SO4====H2↑+CuSO4

图11-3
(1)该装置的名称是____________。
(2)A、B中至少有一种是金属____________,接____________。
(3)C溶液中含有____________。
解析:由于铜的化学活泼性不如氢,所给化学反应不能自发进行,若要使铜能置换出硫酸中的氢元素,需要外加电源,该装置为电解池。在所给反应中铜被氧化,应与电源的正极相连接,故A、B中至少有一种为铜,C溶液应为稀硫酸。
答案:(1)电解池 (2)铜 电源的正极 (3)H2SO4
8.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )
A.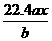 B.
B.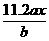 C.
C.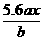 D.
D.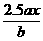
解析:根据电解规律先列出物质间的对应关系式,设M的相对原子质量为Mr。
Mx+-xe--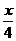 O2
O2
Mr
22.4·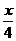
a b
所以Mr=
答案:C
7.把a、b、c、d四块金属片浸入稀酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时电流由d到c;a、c相连时,c极上产生大量的气泡;b、d相连时,b极上有大量气泡产生;则这四种金各的活动顺序由强到弱为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
解析:根据原电池原理,作为负极的金属活动性比正极的金属强,电子流动方向是由负极到正极,电流方向是由正极向负极,因此可依次对电极金属的活动顺序作出如下判断:a>b、c>d、a>c、d>b,综合得本题中全部金属的活动顺序为:a>c>d>b。
答案:B
6.某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1。用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是( )
A.阴极自始至终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
解析:电解质溶液中,n(Na+)∶n(Cl-)∶n(H+)∶n( )=3∶3∶2∶1,开始电解产生H2和Cl2,产生H2和Cl2的同时,生成的OH-中和H2SO4,且OH-过量,最后是电解水,因而最后pH>7,阴极只放出H2。三个阶段分别相当于电解HCl→NaCl→H2O。
)=3∶3∶2∶1,开始电解产生H2和Cl2,产生H2和Cl2的同时,生成的OH-中和H2SO4,且OH-过量,最后是电解水,因而最后pH>7,阴极只放出H2。三个阶段分别相当于电解HCl→NaCl→H2O。
答案:D
5.(2010天津高考理综,12)金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-====Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
解析:考纲要求考生“了解金属的通性、金属冶炼的一般原理”“了解常见金属的活动顺序”,本题考查考生对金属冶炼方法、电解原理及氧化性与还原性的掌握情况,考查考生分析判断和灵活运用知识的能力。电解时阳极失去电子发生氧化反应,电极反应应该依次是Zn、Fe,电极式也错误,A错。电解过程中阳极失电子的金属与溶液中在阴极得电子的金属不同,质量不可能相等,B错。电解后溶液中除Fe2+、Zn2+外还可能有Ni2+,故C错。
答案:D
4.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
解析:电解稀H2SO4,实质上是电解水,硫酸的物质的量不变,但溶液体积减少,浓度增大,故溶液pH减小,A不正确。电解稀NaOH溶液,阳极消耗OH-,阴极消耗H+,实质也是电解水,NaOH溶液浓度增大,故溶液的pH增大,B不正确。电解Na2SO4溶液时,析出H2与O2的物质的量之比为2∶1,C不正确。电解CuCl2溶液时,Cu和Cl2的物质的量之比为1∶1,D正确。
答案:D
3.我国发射上天的宇宙飞船--“神舟”六号上使用氢氧燃料电池,其电池总反应为:2H2+O2====2H2O,电解质溶液溶质为KOH,溶剂是水,反应保持在较高温度下进行,使生成的水不断蒸发,经过一定的处理后供宇航员使用,下列关于该电池的说法中正确的是( )
A.此电池能发出蓝色火焰
B.工作时电解溶液的pH不断减小
C.H2为正极、O2为负极
D.电池放电时负极反应为:2H2+4OH--4e-====4H2O,正极反应为:O2+2H2O+4e-====4OH-
解析:原电池是将化学能转化为电能的装置。显然A不正确。由于电池总反应为:2H2+O2====2H2O,通H2的极为负极,发生的反应为:2H2+4OH--4e-====4H2O,通入O2的极为正极,发生反应为:O2+2H2O+4e-====4OH-。整个过程中KOH没有消耗,而且生成的水不断蒸发,pH基本保持不变。
答案:D
2.(2010江苏高考,16)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)====Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-====Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
解析:由所给电池的总反应式可知,电池工作时,每有1 mol Zn参加反应,失去2 mol电子,则会有2 mol电子从负极Zn开始,流经外电路而流向正极,并在正极发生反应,2MnO2(s)+H2O+2e-====Mn2O3(s)+2OH-(aq),故外电路每通过0.2 mol电子,Zn的质量就减轻6.5 g。
答案:C
1.下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保存
C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D.镀锌的铁比镀锡的铁耐用
解析:A选项是通过构成ZnFe原电池,在船壳上加Zn块构成原电池负极,从而保护船体不被腐蚀。B选项是靠氧化膜保护铝。C选项Zn+Cu2+====Cu+Zn2+,生成的Cu与Zn在溶液中构成原电池加快反应的速率。D选项中ZnFe原电池Zn为负极,而FeSn原电池中Fe为负极,故前者Zn被氧化保护了铁。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com