
题目列表(包括答案和解析)
10.一个体重为50 kg的健康人含铁元素2 g。这2 g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4),服用维生素C,可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+ 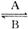 Fe3+的转化,在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
Fe3+的转化,在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
(2)“服用维生素C,可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中作_______,具有____________性。
(3)试简要列举治疗贫血的方法______________。
解析:(1)过程A中,Fe2+转化为Fe3+,失电子,化合价升高,被氧化,而Fe3+本身作还原剂;过程B中刚好相反,Fe3+得电子被还原,而本身作氧化剂。
(2)因为维生素C可将食物中的Fe3+还原为Fe2+,所以维生素C在反应中作还原剂,具有还原性。
(3)由题给信息可知治疗贫血应补充Fe2+或服用维生素C。
答案:(1)还原 还原
(2)还原剂 还原
(3)补充Fe2+或服用维生素C
9.配平下列氧化还原反应方程式,并标明反应④电子转移的方向和数目。
① H2S+
H2S+ H2SO3--
H2SO3-- S↓+
S↓+ H2O
H2O
氧化产物是_________,还原产物是__________,二者质量比是________。
② Cl2+
Cl2+ KOH--
KOH-- KCl+
KCl+ KClO3+
KClO3+ H2O
H2O
氧化剂是________,还原剂是________,二者物质的量之比是__________。
③ KClO3+
KClO3+ HCl--
HCl-- KCl+
KCl+ Cl2↑+
Cl2↑+ H2O
H2O
HCl的作用是________,被还原的元素是__________,当反应过程中有3 mOl电子转移时,可产生氯气________mol。
④ KIx+
KIx+ Cl2+
Cl2+ H2O--
H2O-- KCl+
KCl+ HIO3+
HIO3+ HCl
HCl
若KIx与Cl2的化学计量数之比为1∶8,则x=____________。
答案:①2 1--3 3 S S 2∶1
②3 6--5 1 3 Cl2 Cl2 5∶1
③1 6--1 3 3 还原剂与酸作用 氯酸钾中氯元素1.8
④2 5x+1 6x--2 2x 10x 3

8.现有反应:①CO+CuO Cu+CO2②MgO+2HCl====MgCl2+H2O③Fe+2AgNO3====2Ag+Fe(NO3)2
④CH4+2O2
Cu+CO2②MgO+2HCl====MgCl2+H2O③Fe+2AgNO3====2Ag+Fe(NO3)2
④CH4+2O2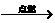 CO2+2H2O⑤NH4HCO3
CO2+2H2O⑤NH4HCO3 NH3↑+CO2↑+H2O,试完成下列问题:
NH3↑+CO2↑+H2O,试完成下列问题:
(1)上述反应中属于置换反应的有__________,属于复分解反应的有__________。
(2)属于氧化还原反应的有__________。
(3)反应③中被还原的元素是__________,反应④中被氧化的元素是__________。
解析:(1)判断置换反应的依据是:单质和化合物反应生成新的单质和化合物,所以答案为③;判断复分解反应的依据是:化合物与化合物反应,相互交换成分,产生另两种新化合物,所以答案选②。
(2)氧化还原反应判断依据是:反应前后元素化合价是否发生改变。①③④中均有元素化合价发生改变,所以答案为①③④。
(3)被还原的元素化合价应该降低,所以③反应中AgNO3中的银元素被还原了;被氧化的元素化合价升高,所以反应④中CH4中的碳元素被氧化了。
答案:(1)③②
(2)①③④
(3)Ag元素C元素
7.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-和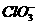 的物质的量浓度之比为11∶1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
的物质的量浓度之比为11∶1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1∶3 B.4∶3 C.2∶1 D.3∶1
解析:做此题时,不要立即动手写化学方程式并配平,应依据电子守恒关系求解。从反应事实可知,Cl2发生歧化反应,既作氧化剂又作还原剂,KClO与KClO3同为氧化产物,KCl为还原产物。每生成1
mol KClO时,Cl2会失去1 mol e-,每生成1 mol KClO3时,Cl2失去5 mol e-;而每生成1 mol KCl时,Cl2则得到1 mol e-。由电子得失守恒关系,有1×n(KClO)+5×n(KClO3)=1×n(KCl),又因为n(ClO-)∶n(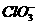 )=11∶1,设n(ClO-)=11 mol,n(
)=11∶1,设n(ClO-)=11 mol,n(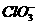 )=1 mol,则不难求出n(Cl-)=16 mol。所以被还原的Cl元素与被氧化的Cl元素物质的量之比为16∶(11+1)=4∶3。
)=1 mol,则不难求出n(Cl-)=16 mol。所以被还原的Cl元素与被氧化的Cl元素物质的量之比为16∶(11+1)=4∶3。
答案:B
6.高氯酸铵加热至483 K时,可完全分解成N2、Cl2、O2和H2O,则反应中氧化产物与还原产物的物质的量之比是( )
A.1∶1 B.1∶3 C.2∶1 D.3∶1
解析:完成2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O↑反应式的配平,正确判断氧化产物为N2、O2,还原产物为Cl2,即可推知,D项正确。
N2↑+Cl2↑+2O2↑+4H2O↑反应式的配平,正确判断氧化产物为N2、O2,还原产物为Cl2,即可推知,D项正确。
答案:D
5.(2010江苏高考,7)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2====2FeCl3+4FeI3
B.Cl2+FeI2====FeCl2+I2
C.Co2O3+6HCl====2CoCl2+Cl2↑+3H2O
D.2Fe3++2I====2Fe2++I2
解析:本题主要考查氧化还原反应的先后顺序和反应原则,侧重考查考生分析判断能力及对氧化还原反应实质的理解。氧化还原反应发生的条件是强氧化剂+强还原剂弱还原剂====弱氧化剂。A中反应物I-的还原性>Fe2+的还原性,故Cl2应首先氧化强还原性I-而不是Fe2+,故A反应错误,选A。
答案:A
4.(2010北京西城检测)在泡沫橡胶的制造中,要利用下面反应放出的氧气:2H2O2 2H2O+O2↑,该反应中的双氧水( )
2H2O+O2↑,该反应中的双氧水( )
A.仅为氧化剂 B.仅为还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
解析:本题考查有关氧化还原反应的知识,在反应中H2O2既得电子又失电子,C正确。
答案:C
3.(2010山东烟台高三模拟)世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。下列说法正确的是( )
A.ClO2是强氧化剂 B.ClO2是强还原剂
C.ClO2是离子化合物 D.ClO2中氯元素为-1价
解析:ClO2是共价化合物,其中氯元素化合价为+4,具有强的氧化性,能杀菌消毒,故A正确,B、C、D错误。
答案:A
2.用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红色变为绿色,用这种现象可测得司机是否酒后驾车。反应如下:
2CrO3+3C2H5OH+3H2SO4====Cr2(SO4)3+3CH3CHO+6H2O,此反应中的氧化剂是( )
A.H2SO4 B.CrO3 C.Cr2(SO4)3 D.C2H5OH
解析:考查考生对氧化剂、还原剂概念的理解和分析问题的能力。分析题干时了解到反应中元素价态的变化是解题的切入点。根据化学方程式可知,反应物CrO3中的Cr为+6价,生成物Cr2(SO4)3中的Cr为+3价,Cr的价态降低,所以反应物CrO3是氧化剂。
答案:B
1.(2010山东济宁高三测试)下列叙述正确的是( )
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素的化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原时不一定得到金属单质
解析:本题考查的知识点有物质的组成、元素化合物及氧化还原反应。此类问题只要找出一个否定因素,就把某选项否定了。因此今后学习中要对化学知识中某些特殊性多加注意。A:因 中有金属元素Mn,故不正确。B:因S+O2
中有金属元素Mn,故不正确。B:因S+O2 SO2中S是还原剂,故B不正确。C:因Cu2+
SO2中S是还原剂,故B不正确。C:因Cu2+ Cu(被还原),S2-
Cu(被还原),S2- S(被氧化),故不正确。D:因Fe3+可被还原为Fe,也可被还原为Fe2+,故正确。
S(被氧化),故不正确。D:因Fe3+可被还原为Fe,也可被还原为Fe2+,故正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com