
题目列表(包括答案和解析)
6.下列广告用语从化学角度看,没有科学性错误的是 ( )
A.“K”牌咖啡,滴滴香浓,绝不含任何化学物质
B.食用合格“碘盐”,可预防某种甲状腺疾病
C.“大自然”牌蔬菜,天然种植,不含任何元素,真正的“绿色”食品
D.“雪山牌”矿泉水,真正的纯水
29. 一种名为苹果醋(ACV)的浓缩饮料,近年来风靡全球。ACV是一种有苹果发酵而成的酸性饮品,是具有明显的药效的健康食品,有解毒、降脂、减肥和止泻功能。苹果酸是这种饮料中的主要物质。某同学为了探究苹果酸的组成和结构。
根据题干叙述提出猜想:
①苹果酸应由C、H、O三元素组成,且不可能含有N、S、Cl元素;
②苹果酸分子中至少含有一个羧基,可能含有羟基。
(1)为验证猜想,该生设计如下实验:
①取一定量洁净的苹果酸在空气中燃烧,通过燃烧现象可以证实猜想①是正确的。该生的依据是 ;
②如果要测定组成该酸C、H、O 三元素的组成比,该生还需要做哪些实验
③假设测得C、H、O的质量比为24:3:40,又知苹果酸蒸气的密度是同温同压下氢气密度的67倍,则苹果酸的分子式为 。
(2)为了验证猜想②并探究苹果酸的分子结构,该生取0.1摩尔该酸与足量的NaHCO3溶液反应放出4.48LCO2,与足量的金属钠作用放出3.36LH2(气体体积已折成标准状况下的体积)。假设该分子没有支链,则该酸分子的结简式为 。
(3)请写出苹果酸在一定条件下,每个分子发生分子间脱水生成环酯的所有结构简式:
。
。
28. 过碳酸钠(Na2CO4)跟稀硫酸反应的化学方程式如下:
过碳酸钠(Na2CO4)跟稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4 2Na2SO4+2CO2↑+O2↑+2H2O。今有如下图所示装置可供选择,请回答:
(1)若过碳酸钠中含有少量碳酸钠杂质,欲测定该样品中Na2CO4的质量分数:
①应选用的仪器是________________(填代号),
②请叙述读取量筒数据的正确方法: 。
③若样品质量25 g,测得气体体积为2.24 L(标准状况),则该样品中Na2CO4的质量分数为 。
(2)若过碳酸钠中含有少量过氧化钠(2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O)杂质,欲测定该样品中Na2CO4的质量分数:
①仪器接口的连接顺序为P-A-B-( )-( )-( )-( )-( );
②高压氮气的作用是______________________________ _____ ___________;
③若相关装置反应前后的质量分别为w1g和w2g,样品质量为ng,则该样品中Na2CO4的质量分数为 。(用w1、w2、n表示)
27.某研究性学习小组的同学为在实验室再现二氧化硫催化氧化的过程,同时制取少量三氧化硫晶体,并测量反应后混合气体中SO2的含量,设计了如图所示的装置。

已知:V2O5在450℃左右,活性最好,温度过高或过低都会使催化剂活性下降。
(1)已知3.2g二氧化硫被氧气完全氧化成三氧化硫时,可以放出4.915kJ热量。则该反应的热化学方程式为 。
(2)A装置可用来观察SO2和氧气的进气量。实验时使A中氧气导管冒出的气泡与SO2导管冒出的气泡速率相近,其目的是 。
(3)检查完装置的气密性且加入药品后,开始进行实验。此时首先应该进行的操作是
。
(4)在实验过程中不能持续加热的理由是 。
(5)冰盐水的作是 。
(6)能用于测定反应后混合气体中SO2含量的是 (填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
13.下列溶液中各微粒的浓度关系不正确的是
A.Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.向醋酸钠溶液中加入醋酸至溶液呈酸性时:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.NaHCO3溶液中: c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
第Ⅱ卷
26根据下列题目要求,回答下列问题:
(1)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。事实上,硫酸的第一步电离是完全的:H2SO4= H++ HSO4-,第二步电离并不完全:HSO4-  H++
SO42- 。
H++
SO42- 。
①.则Na2SO4溶液呈______ ___(填弱酸性、中性或弱碱性),其理由是(用离子方程式表示) _____________ _________________________ _。
②写出硫酸与氯化钡溶液反应的离子方程式:___________ _____________ 。
(2)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是:___________________________ _;
在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是:_________________________________ _____________ _____________。
(3)把氯化亚铁水溶液中的Fe2+氧化为Fe3+,而不引进原溶液中不含有的其它金属阳离子或阴离子,所用的两种方法的离子方程式分别为: 。
。
12.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
11.下列说法中不正确的是
A.电解熔融氧化铝制单质铝,常加入Na3AlF6,可降低氧化铝的熔点
B.从海水中提取镁的最后一步反应是电解熔融的MgCl2而不是熔融的MgO
C.精炼铜时,纯铜作阳极,粗铜作阴极,硫酸铜溶液作电解质溶液
D.在 Fe+RCH2X+H+=RCH3+Fe2++X-反应中,卤代烷作氧化剂
10.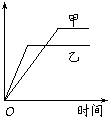 如图所示。该图象表示下表中的情形
如图所示。该图象表示下表中的情形
|
|
反应 |
纵坐标 |
甲 |
乙 |
|
A |
等质量钾、钠分别与水反应 |
H2质量 |
钠 |
钾 |
|
B |
相同质量氨,在同一容器中 2NH3  N2+3H2 N2+3H2 |
氨气的转化率 |
400℃ |
500℃ |
|
C |
体积比1∶3的N2,H2,在体积可变的恒压容器中, N2+3H2  2NH3 2NH3 |
氨气的浓度 |
活性高的催化剂 |
活性一般的催化剂 |
|
D |
2mo1SO2与lmo1O2,在相同温度下 2SO2+O2  2SO3 2SO3 |
SO3的物质的量 |
105Pa |
2×105Pa |
9.四川汶川大地震后,水体受污染,保证饮用水安全是灾区人民必须解决的第一个问题。高铁酸盐(如K2FeO4)是新型、高效、多功能水处理剂。其与水反应的离子方程式是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2+8OH-。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下: 湿法制备--2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备--2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生氧化反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降
8.一定条件下,可逆反应C(s) + CO2(g)
 2CO(g) △H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度 ②增加反应物C的用量 ③缩小反应体系的体积 ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) △H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度 ②增加反应物C的用量 ③缩小反应体系的体积 ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com