
题目列表(包括答案和解析)
9.教授Jerry Woodall在实验室中,清洗一个含有液态镓和铝合金的坩埚时,偶然地发现: 当液态合金中的铝原子与水接触时,它们之间发生了反应,使水爆裂开,并产生氢气和铝氧化物。这一发现可能会使发动机本质上要燃烧水,而不是汽油,这是因为镓在反应中不会被消耗,而铝能被循环使用。有关说法正确的是( )
A.铝元素、镓元素均位于第ⅢA族 B.从上述现象说明铝的还原性比镓弱
C.铝与水反应的离子方程式为:2Al+2OH-+2H2O====AlO2-+3H2↑
D.与水反应生成的铝氧化物,在高温下熔融,用氢气还原可制得铝
6. 2007年8月4日5时26分(北京时间17时26分),美国“凤凰”号火星着陆探测器顺利升空,开始飞往火星之旅。“凤凰”号上专门放了一张袖珍光盘,里面记录了这名科学家、哲学家、科幻小说家等对火星的“梦想”。这张光盘由石英玻璃制成,能在火星上待500年。石英玻璃是用较纯净的二氧化硅制成的。下列关于二氧化硅和石英玻璃的有关说法不正确的是:
A.二氧化硅晶体是原子晶体
B.石英玻璃中含有硅酸盐、二氧化硅,耐任何酸碱腐蚀
C.石英玻璃制成的光导纤维是一种新型无机非金属材料
D.石英玻璃有较高的熔点
*7.下列反应的离子方程式中正确的是( )
A.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应:
CH3OH+H2O – 6e-===CO2↑+6H+
B.在NaHSO4溶液中加Ba(OH)2至中性:H++SO42-+Ba2++OH-===BaSO4↓+H2O
C.苯酚钠的水溶液中通入少量的CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32-
D.用侯氏制碱法制得NaHCO3:Na++NH3+CO2+H2O===NaHCO3↓+NH4+
*8.2007年7月1日起中国全面禁止生产、进口、销售氟利昂和哈龙等制冷剂,为国际保护臭氧层行动做出了重大贡献。氟利昂-12(CCl2F2)是一种过去用量较多的冰箱制冷剂。下列关于CCl2F2的说法正确的是:
A.有两种同分异构体 B.所有原子在同一平面上
C.易气化,不易液化 D.是卤代烃
29.(10分)
(1)0.2mol (2分)
(2)Cu有剩余(2分) ;0.3mol(2分)
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分);2.24L. (2分)
28、(10分)(1)C10H10O2 (2)A、C (3)
(4)①羧基、羟基 ②酯化反应“或取代反应”,

③ 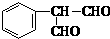
27.(8分)
⑴ NH3 (1分) NaAlO2 (1分)
⑵ (2分)
⑶ CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(2分)
CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-(2分)
或CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
 ⑷ Al4SiC4+2N2
⑷ Al4SiC4+2N2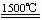 4AlN+SiC+3C(2分)
4AlN+SiC+3C(2分)
26.(10分)
(1)(NH4)2SO4 (2分)
(2)①C3H6N6 (2分) 66.7% (2分)
②AC(2分)
③18.8 g(2分)
29.(10分)将32.0 g Cu投入50mL 12moL/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是 mol。
(2)判断32.0gCu和50mL 12moL/L的硝酸反应后何者有剩余? ,其物质
的量是 mol。
(3)如果往反应后的体系内再加入100mL2mol/L的稀硫酸,充分反应后又有气体逸出,
写出离子反应方程式 ,并计算新产生气体的体积(标准状况) 。
化学知识点考察检测(2)
ADCB CABA
13.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:

下列推断不合理的是
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.往甲中通CO2有利于(NH4)2SO4生成
*26.2008年10月8日,瑞典皇家科学院宣布将诺贝尔化学奖授予日本科学家下村修、美国科学家马丁·沙尔菲与美籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%-18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机
含氮化合物,反应式为:2(-NH2)+H2SO4+2H+ 。
。
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为 。
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋
 白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉
白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉
中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,
导致许多婴幼儿肾结石。
① 三聚氰胺的结构如图所示,其化学式为 ,
含氮量(氮元素的质量分数)为 ;
② 下列关于三聚氰胺的说法中,正确的有 ;
A.三聚氰胺是一种白色结晶粉末,无色无味,所以掺入奶粉后不易被发现
B.三聚氰胺分子中所有原子可能在同一个平面上
C.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
③ 假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白
质含量为0的假奶粉中掺入 g的三聚氰胺就可使奶粉“达标”。
*27.下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的最外层电子数和原子数,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。

回答下列问题:
(1) 写出下列物质的化学式:F ,I ;
(2) 写出反应③的化学方程式: ;
(3) 写出反应⑥的离子方程式: ;
(4) B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应①是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1∶4,写出反应①的化学方程式: 。
28(10分)肉桂酸甲酯(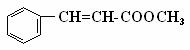 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是 ;
(2)有关肉桂酸甲酯的叙述中,正确的是 (填标号);
A.能与溴的四氯化碳溶液发生加成反应 B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.不可能发生加聚反应
 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
右图所示(图中球与球之间连线表示单键或双键)。G的
结构简式为 ;
(4)用芳香烃A为原料合成G的路线如下:

① 化合物E中的官能团有 (填名称)。
② F→G的反应类型是 ,该反应的化学方程式为 。
③ 写出符合下列条件的F的同分异构体的结构简式 。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
10.某金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
*11.NH4Cl是强酸弱碱盐,它在水溶液里的水解过程可用下图表示:

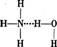 则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
则下列有关NH4 Cl溶液里存在的微粒的叙述,不正确的是
A.存在NH3·H2O,其结构式为 B.存在NH4+,其电子式为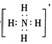

 C.存在H3O+,其结构式为 D.存在OH-,其电子式为12.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法中不正确的是
C.存在H3O+,其结构式为 D.存在OH-,其电子式为12.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法中不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.PCl3的水解产物是HClO和PH3
C.NaClO的水解产物之一是HClO D.Mg3N2的水解产物是两种碱性物质
7. 硒被称为主宰生命的元素之一,人们开发了一种含有钙铁锌硒(Ca、Fe、Zn、Se)的保健品。下列说法正确的是
A.四种元素均处于第四周期,且均是主族元素
B.H2Se比H2O热稳定性好
C.单质钙能从FeSO4溶液中置换出铁
D.保键品为人体提供了必需的Fe、Zn、Se等微量元素
*8.下列有关物质分类或归类正确的是
①混合物:盐酸、漂白粉、水玻璃、水银 ②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银 ④同素异形体:C60、C70、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、碳酸钙高温分解、甲烷燃烧
A.①③④ B.②③④ C.③④ D.④⑤
*9.设NA为阿伏加德罗常数,下列说法中正确的是
A.标准状况下,1L液态水中含有的H+ 数目大于10-7NA
B.足量Zn与一定量的浓硫酸反应,标准状况下产生22.4L气体时,转移的电子数为2NA
C.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
D.1molFeCl3完全水解生成NA个胶体粒子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com