
题目列表(包括答案和解析)
8.下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水。未发生化学键破坏的是________;仅发生离子键破坏的是________;仅发生共价键破坏的是________;既发生离子键破坏,又发生共价键破坏的是________。
解析:分子晶体升华、熔化破坏的是分子间作用力,未破坏化学键;离子晶体熔化或溶于水破坏的是离子键;电解质溶于水发生电离,破坏的是化学键(离子键、共价键);某些化合物溶于水时,如Na2O2先破坏Na+与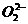 的离子键,然后破坏O-O非极性共价键。
的离子键,然后破坏O-O非极性共价键。
答案:①⑤ ②③ ④ ⑥
7.(2010辽宁沈阳高三模拟)常见的离子晶体类型有5种,图5-3是其中一种空间构型,则该晶体中X、Y的离子个数之比可能为( )
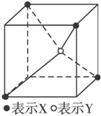
图5-3
A.4∶1 B.2∶1 C.1∶1 D.1∶2
解析:此晶体晶胞为立方体,则顶点上的原子属于此晶胞的只占1/8。故X∶Y=4×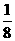 ∶1=1∶2。选D。
∶1=1∶2。选D。
答案:D
6.最近,科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为一种空间网状的无限伸展结构。下列对该晶体叙述错误的是( )
A.该物质的化学式为CO4
B.晶体的熔沸点高,硬度大
C.晶体中C原子数与C-O化学键之比为1∶4
D.晶体的空间最小环共由12个原子构成
解析:分析题意可知,该新型碳氧化合物属于原子晶体,以C-O键结合为一种空间网状的无限伸展结构,使学生容易联想到晶体SiO2的结构,故B、C、D正确。而A项中描述的化学式应为CO2,而不是CO4,故A错误。
答案:A
5.根据下列实验事实,确认某晶体一定是离子晶体的是( )
A.晶体熔点达2500 ℃ B.晶体不导电,溶于水能导电
C.晶体不导电,熔融能导电 D.温度越高,溶解度增大
解析:离子晶体、原子晶体、金属晶体的熔点一般都比较高,故A不正确。离子晶体、原子晶体、分子晶体不导电,但离子晶体和某些分子晶体溶于水后能导电,B不正确。一般情况下,温度升高,物质(除气体、Ca(OH)2外)的溶解度增大,D不正确。
答案:C
4.(2010广东中山统一检测)已知白磷(P4)是一个内空的正四面体结构,四个磷原子处于四个顶点(如图52所示),白磷被氧化可生成六氧化四磷(P4O6),六氧化四磷的分子中只有单键,且每个原子的最外层都满足8个电子的结构,则该分子中含有共价键的数目是( )
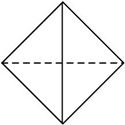
图5-2
A.10 B.12 C.24 D.28
解析:根据白磷的结构可知,P4O6可看作白磷分子中每个磷磷键中插入一个氧原子而得,又已知该分子中只含有单键,因此P4O6分子中含有的共价键数目为6×2=12。
答案:B
3.下列物质中,既含有离子键,又含有非极性共价键的是( )
A.NaOH B.Na2O2 C.CaCl2 D.H2O
解析:NaOH中含离子键,OH-中含极性共价键。Na2O2含离子键,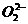 中含非极性键,CaCl2中只含离子键,H2O中只含极性键。
中含非极性键,CaCl2中只含离子键,H2O中只含极性键。
答案:B
2.(2010北京西城检测)下列说法正确的是( )
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.两种元素组成的化合物中一定不含非极性键
D.由于水分子之间存在氢键,所以水分子比较稳定
解析:本题考查物质结构与化学键的知识,离子化合物中可含有共价键,A错误;两种元素组成的化合物中可含有非极性键,如:Na2O2,C错误;分子稳定与分子间力无关,D错误;B正确。
答案:B
1.下列叙述正确的是( )
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.金属离子都一定满足最外电子层2或8电子结构
D.共价化合物中各原子都一定满足最外层8电子结构
解析:离子化合物如NaOH中氢氧之间为共价键;具有离子键的化合物一定是离子化合物,不可能是共价化合物,A正确,B错。Fe2+最外层有14个电子,故C不正确。共价化合物HCl中H原子不满足8电子结构,D不正确。
答案:A
1.35 g 0.075 mol
2x∶1.35 g=3 mol∶0.075 mol
解得x=27 g
根据质量数=质子数+中子数,可求得该元素的质子数为:27-14=13,为铝元素。
答案: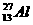
11.某R元素的单质1.35 g与足量稀硫酸充分反应生成R2(SO4)3和1.68 L氢气(标准状况),求R的相对原子质量。若R元素原子核内有14个中子,请写出该核素的符号。
解析:本题通过由化学方程式求算元素原子的相对原子质量,巩固了原子结构的知识。
设R的相对原子质量为x,
n(H2)=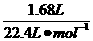 =0.075 mol
=0.075 mol
2R+3H2SO4====R2(SO4)3+3H2↑
2x 3 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com