
题目列表(包括答案和解析)
6.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(式中NA为阿伏加德罗常数)( )
A.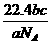 L
B.
L
B. L
L
C.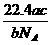 L
D.
L
D.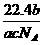 L
L
解析:根据阿伏加德罗定律,气体的质量之比等于它们的物质的量之比: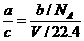 ,则V=
,则V=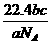 L。
L。
A选项是正确的,B、C、D选项是错误的。因为a、c的单位是g,则a、c不能同时在分子或分母中。
答案:A
5.同温同压下,1体积氮气和3体积氢气化合生成2体积氨气。已知氮气和氢气都由最简单分子构成,推断他们都是双原子分子和氨的化学式的主要依据是( )
①阿伏加德罗定律 ②质量守恒定律 ③原子或分子数只能为整数 ④化合价规则
A.①③ B.①②③ C.①②④ D.①②③④
解析:可设氮气、氢气的化学式分别为Nx、Hy,氨气为NaHb,由阿伏加德罗定律知化学反应式为Nx+3Hy====2NaHb,其中x、y、a、b只能为正整数,由反应前后原子种类、个数不变(质量守恒定律)可知:
x=2a,3y=2b,得x只能为偶数,y也只能为偶数,即此时推论已应用了①②③的内容。故答案为B。
答案:B
4.(2010江苏南通检测)NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol HNO3见光分解,转移电子数4NA
B.28 g晶体硅中含有Si-Si键的数目为2NA
C.100 mL 0.5 mol·L-1的(NH4)2SO4溶液中,含有0.1NA个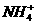
D.Cu与浓硝酸产生的22.4 L(标准状况)气体中含原子数为3NA
解析:由4HNO3====2H2O+4NO2↑+O2↑知,1 mol HNO3完全分解可转移1 mol电子,但由于见光只是部分分解,故A错。由于NH+4在水溶液中水解,故NH+4数小于0.1 mol,C错。Cu与浓HNO3反应,主要产物是NO2,但也有少量NO,故22.4 L气体中所含原子数会少于3 mol,D错。B正确。
答案:B
3.下列条件下,两种气体的分子数一定不相等的是( )
A.相同质量、不同密度的N2和C2H4
B.相同体积、相同密度的CO和C2H4
C.相同温度、相同压强、相同体积的O2和N2
D.相同压强、相同体积、相同质量的O2和N2
解析:A.N2和C2H4的摩尔质量相同,相同质量的N2和C2H4,物质的量相同,分子数也相同。
B.相同体积、相同密度的CO和C2H4,具有相同的质量,同时也具有相同的分子数。
C.同温同压下同体积的任何气体具有相同的分子数。
D.同质量的O2和N2,摩尔质量不同,物质的量不同,从而分子数不相等,故D错误。
答案:D
2.(2010北京东城检测)NA代表阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,22.4 L H2所含氢原子数目为2NA
B.1.8 g NH+4所含电子数目为NA
C.58.5 g NaCl晶体中所含的氯化钠分子数目为NA
D.1 L 1
mol·L-1 Na2CO3溶液中所含的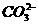 数目为NA
数目为NA
解析:A.常温常压下,不能应用22.4 L·mol-1进行计算。C.NaCl是离子晶体,无分子存在,存在的是离子。D.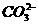 水解,使其数目减少。
水解,使其数目减少。
答案:B
1.下列说法中不正确的是( )
A.1 mol某气体的体积为22.4 L,该气体所处的状态不一定是标准状况
B.非标准状况下,1 mol任何气体的体积可能是22.4 L
C.某气体含有NA个原子,该物质在标准状况下的体积一定是22.4 L
D.任何状况下,1 mol CO2和1 mol H2O所含的分子数和原子数都相等
解析:本题主要考查气体摩尔体积概念的内涵和本质。尤其要注意标准状况下22.4 L·mol-1的使用。因为在非标准状况下,1 mol气体的体积也可能为22.4 L,所以A、B正确;当气体为单原子分子的稀有气体时符合C选项,而双原子或多原子分子不符合,C错;因为比较粒子数实质是比较它们的物质的量,所以D正确。
答案:C
11.在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有着密切的关系。约占人体总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,其余0.03%是由10多种人体不可缺少的微量元素组成。在微量元素中,只有F和Si位于短周期,其余均属第1长周期。在宏量元素中,除H、N、P外,在现用周期表的其余元素中(写出元素符号):
(1)原子最外层电子数是最内层电子数2倍的是________________________。
(2)能显示化合价最多的元素是____________,跟它处在同一周期的还有一种非金属元素是____________ 。
(3)原子半径最大的是____________,它的相邻元素是_____________。
(4)剩余的两种元素,它们的离子电子层结构相同,且带电量也相同,但符号相反,这两种元素是_____________和_____________。
(5)氨基酸的主要组成元素为_____________。
解析:题目给出了与生命科学相关的大量信息,需结合生物学知识和元素周期表知识正确分析解答。
答案:(1)C (2)Cl S (3)K Na、Ca(4)Mg O (5)C、H、O、N
10.同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。请完成下列问题:
(1)根据以上条件一定能判断出的元素有几种,请在下列横线上写出相应的元素符号:
A._____________,B._____________,C._____________,
D._____________,E._____________,F._____________。
(2)已知D单质在F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式: ____________________________________;____________________________________。
(3)若1 mol F的最高价氧化物对应水化物与C的最高价氧化物对应水化物恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物对应水化物反应消耗_____________mol A的最高价氧化物对应水化物。
解析:(1)A、C、E三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,那么其中两种最高价氧化物对应水化物应为酸和碱,而另外一种水化物既能与酸反应,又能与碱反应,必为两性氧化物,中学范围内只有Al2O3了。又知A、B、C、D、E、F同周期,且原子序数依次增大,则C应为Al,A为金属,F为非金属,C之前的A、B应依次为Na、Mg。A、C、F最外层电子数共为11,则F最外层电子数为11-1-3=7,所以F应为Cl元素。
(2)D在周期表中位置在Al、Cl之间,可能为Si、P,不可能为S,因为E的序数大于D小于F,那么在Cl2中燃烧生成两种产物的应为P。
3Cl2+2P 2PCl3
2PCl3
2P+5Cl2 2PCl5
2PCl5
(3)A、F最高价氧化物对应水化物分别为NaOH、HClO4,与C最高价氧化物对应水化物Al(OH)3的反应分别为:
NaOH+Al(OH)3====NaAlO2+2H2O
3HClO4+Al(OH)3====Al(ClO4)3+3H2O
若HCl为1 mol,则Al(OH)3为 mol,消耗NaOH
mol,消耗NaOH mol。
mol。
答案:(1)Na Mg Al
P S Cl (2)2P+3Cl2 2PCl3 2P+5Cl2
2PCl3 2P+5Cl2 2PCl5 (3)
2PCl5 (3)
9.周期表前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素,且原子半径依次减小,其中A和E同族,A与C、B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1∶4。
(1)写出元素符号:B_____________,D_____________,E_____________。
(2)A和C能以原子数1∶1形成一种化合物,写出该化合物的化学式:_____________。
解析:由A、B原子最外层电子数之比为1∶4,且五种元素皆不是稀有气体元素,知A为第ⅠA族元素,B为第ⅣA族元素,又五种元素皆为前20号元素,故B可能为C或Si;又结合A、E同主族,B、E相差两个电子层可推知B为Si、E为H;由A、C相差两个电子层可知C定在第2周期,A为K;又A、B、C、D、E原子半径依次减小,且A、C可形成1∶1型化合物,故C为O,D为F,A、C形成的化合物为K2O2。
答案:(1)Si F H (2)K2O2
8.(2010河北石家庄高三检测)X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是___________;Y和X的组成元素相同,Y的化学式是____________;1 mol Z在加热时跟水反应的产物需要用6 mol的氢氧化钠才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是________________________。
解析:由X与水反应生成具有还原性酸知X中除氧外的另一元素R有多种可变价态,应为非金属,又X与水反应生成二元酸知,该元素R为ⅣA族或ⅥA族元素,但CO不与水反应,所以短周期的氧化物中符合题意的只有SO2,对应的酸为H2SO3;与SO2的组成元素相同的物质为SO3;由1 mol Z与H2O反应的产物需6 mol NaOH,才能完全中和,说明该水合物为三元酸,Z中除氧外的另一元素是第ⅤA族元素,所以单质A为磷。
答案:H2SO3 SO3 磷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com