
题目列表(包括答案和解析)
6.强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)====H2O(l);ΔH=-57.3 kJ·mol-1,向1 L 0.5 mol·L-1的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH2>ΔH1>ΔH3 D.ΔH1>ΔH3>ΔH2
解析:强酸的H+与强碱的OH-在稀溶液中发生中和反应的热效应:H+(aq)+OH-(aq)====H2O(l);ΔH=-57.3 kJ·mol-1。由于稀醋酸中主要是醋酸分子,当醋酸和NaOH发生中和反应时,醋酸的电离平衡向电离的方向移动,电离过程要吸热,因此中和反应放出的热量小于57.3 kJ·mol-1,ΔH1>-57.3 kJ·mol-1;而H2SO4稀释时要放出热量,所以ΔH2<-57.3 kJ·mol-1,故D符合题意。
答案:D
5.(2010全国理综Ⅰ,13)已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式别为C(石墨,s)+O2(g)====CO2(g);ΔH=-393.51 kJ·mol-1
C(金刚石,s)+O2(g)====CO2(g);ΔH=-395.41 kJ·mol-1
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
解析:根据盖斯定律,将方程式①减去方程式②,得到下列热化学方程式:
C(石墨,s)====C(金刚石,s);ΔH=1.91 kJ·mol-1
说明由石墨制备金刚石是吸热反应,吸收的热量以化学能的形式贮存在金刚石中,也就是同质量金刚石具有的能量比石墨高。A选项正确。
答案:A
4.(2010北京东城检测)氢气是人类最理想的能源。已知在25 ℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2====2H2O;ΔH=142.9 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(l);ΔH=-142.9 ·mol-1
C.2H2(g)+O2(g)====2H2O(l);ΔH=-571.6 ·mol-1
D.2H2(g)+O2(g)====2H2O(l);ΔH=+571.6 ·mol-1
解析:热化学方程式应包含物质的状态,ΔH的值与物质的物质的量一致,故A错,B错。D错,应为“-”。
答案:C
3.(2010全国理综Ⅰ,13)已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH=-4b kJ·mol-1
B.C2H2(g)+ O2(g)====2CO2(g)+H2O(l);ΔH=2b kJ·mol-1
O2(g)====2CO2(g)+H2O(l);ΔH=2b kJ·mol-1
C.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH=-2b kJ·mol-1
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l);ΔH=b kJ·mol-1
解析:放热反应中ΔH<0,所以B、D错误。生成1 mol CO2时放出b kJ的热量,所以,生成4 mol CO2时放出热量为4b kJ,所以A正确。
答案:A
2.2003年10月15日,我国“神舟”五号载人飞船成功发射。航天飞船是用铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4ClO4 N2↑+4H2O+Cl2↑+2O2↑;ΔH<0。下列对该反应的叙述不正确的是( )
N2↑+4H2O+Cl2↑+2O2↑;ΔH<0。下列对该反应的叙述不正确的是( )
A.高氯酸铵的水溶液呈酸性
B.该反应属于分解反应、氧化还原反应、放热反应
C.该反应中反应物的总能量小于生成物的总能量
D.反应从能量变化上说,主要是化学能转变为热能和动能
解析:高氯酸为强酸,故高氯酸铵为强酸弱碱盐, 水解呈酸性;该反应为放热反应,故反应物的总能量比生成物的总能量大。
水解呈酸性;该反应为放热反应,故反应物的总能量比生成物的总能量大。
答案:C
1.有专家提出,如果对燃料燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之变成CH4、CH3OH、NH3等的构思(如图1-1)能够实现,那么不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机,在此过程中太阳能最终转化为( )
A.化学能 B.生物能
C.热能 D.电能

图1-1
解析:CO2、H2O、N2转化为燃料时将太阳能转化为化学能,燃料燃烧时又将化学能转化为热能。
答案:C
10.(2010山东临沂高三模拟)摩尔质量为M g·mol-1的某物质溶解度曲线如图32,现有t2 ℃时300 g该物质的溶液,恒温蒸发掉50 g水后,溶液恰好达到饱和,此饱和溶液的密度为ρ g·mL-1,则其物质的量浓度为____________ mol·L-1。若将饱和溶液降温到t1 ℃析出晶体(不含结晶水)的质量为____________ g。

图3-2
解析:依据溶液计算的相关原理,从溶解度与质量分数的关系、物质的量浓度与质量分数的关系、物质的量浓度与溶解度的关系等方面入手解题。
答案:(1) (2)
(2) ×250
×250
9.在t ℃时a g某化合物饱和溶液的体积为b mL,将其蒸干后得到c g摩尔质量为ρ g·mol-1的不含结晶水的固体物质。计算:
(1)此物质在t ℃时的溶解度_______________。
(2)在t ℃时此化合物的饱和溶液中溶质的物质的量浓度_______________。
解析:(1)设该化合物在t ℃时溶解度为S,则有:
(a-c) g∶c g=100 g∶S S= g
g
(2)c(B)= mol·L-1
mol·L-1
答案:(1) g (2)
g (2) mol·L-1
mol·L-1
8.把27.2 g Fe和Fe2O3的混合物溶于500 mL稀H2SO4中,完全反应后放出标准状况下的H2 4.48 L,向该溶液中滴入少量NH4SCN溶液,无颜色变化。再加入2 mol·L-1的NaOH溶液,至pH=7时共消耗NaOH溶液500 mL。求原稀H2SO4的物质的量浓度___________________。
解析:反应的最终结果:溶液只是Na2SO4溶液。因为溶液中电荷守恒,所以n(NaOH)=2n(H2SO4),即c(NaOH)·V(NaOH)=2c(H2SO4)·V(H2SO4)。因为V(NaOH)=V(H2SO4)=0.5 L,所以c(H2SO4)=0.5c(NaOH)=1 mol·L-1。
答案:1 mol·L-1
7.(2010北京东城检测)t ℃时,甲、乙两个烧杯中各盛有浓度相同、质量相等的不饱和的KCl溶液,一份蒸发掉m g水,冷却到原温度,析出a g晶体(不含结晶水);另一份蒸发掉n g水,冷却到原温度,析出b g晶体。则t ℃时KCl的溶解度是( )
A. ×100 g
B.
×100 g
B. g
g
C. ×100 g D.
×100 g D. ×100 g
×100 g
解析: =
=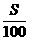 ,S=
,S= ×100 g。
×100 g。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com