
题目列表(包括答案和解析)
1、(2001年全国春招题)在0.1mol·L-1 Na2CO3溶液中,下列关系正确的是( c )。
A.c(Na+)=2c(CO32-
B.c(OH-)=2c(H+)
C.c(HCO3-)>c(H2CO3)
D.c(Na+)<c(CO32-)+c(HCO3-)
5.强碱弱酸的酸式盐溶液:
[例5](2004年江苏卷)草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是(CD)
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B.c(HC2O4-)+ c(C2O42-)=0.1mol/L
C.c(C2O42-)>c(H2C2O4)
D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)
[解析]因为草酸氢钾呈酸性,所以HC2O4-电离程度大于水解程度,故c(C2O42-)>c(H2C2O4)。又依据物料平衡,所以D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)正确,又根据电荷守恒,c(K+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),所以。综合上述,C、D正确。
练习:
4.强碱弱酸盐溶液:
[例4]在Na2S溶液中下列关系不正确的是
A. c(Na+) =2c(HS-) +2c(S2-) +c(H2S)
B.c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)>c(S2-)>c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+c(H2S)
解析:电荷守恒:c(Na+) +c(H+)=c(OH-)+c(HS-)+2c(S2-);
物料守恒:c(Na+) =2c(HS-) +2c(S2-) +2c(H2S);
质子守恒:c(OH-)=c(HS-)+c(H+)+2c(H2S),选A D
3.强酸弱碱盐溶液:
[例3]在氯化铵溶液中,下列关系正确的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) H4+)>c(Cl-)>c(H+)>c(OH-)
H4+)=c(Cl-)>c(H+)=c(OH-) D.c(Cl-)=c(NH4+)>c(H+)>c(OH-)
分析:由于氯化铵溶液中存在下列电离过程:NH4Cl=NH4++Cl-,H2O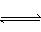 H++OH-和水解过程:NH4++H2O
H++OH-和水解过程:NH4++H2O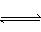 H++NH3·H2O,由于铵离子水解被消耗,所以c(Cl-)>c(NH4+),又因水解后溶液显酸性,所以c(H+)>c(OH-),且水解是微量的,所以上述关系式正确的是A项。(注意:解答这类题目时主要抓住弱碱阳离子的水解,且水解是微量的,水解后溶液呈酸性。)
H++NH3·H2O,由于铵离子水解被消耗,所以c(Cl-)>c(NH4+),又因水解后溶液显酸性,所以c(H+)>c(OH-),且水解是微量的,所以上述关系式正确的是A项。(注意:解答这类题目时主要抓住弱碱阳离子的水解,且水解是微量的,水解后溶液呈酸性。)
2.弱碱溶液:
[例2]室温下,0.1mol/L的氨水溶液中,下列关系式中不正确的是( )
A. c(OH-)>c(H+) H3·H2O)+c(NH4+)=0.1mol/L
H4+)>c(NH3·H2O)>c(OH-)>c(H+) D.c(OH-)=c(NH4+)+c(H+)
分析:由于氨水溶液中存在一水合氨的电离平衡和水的电离平衡,所以所得溶液呈碱性,根据电荷守恒和物料守恒知BD正确,而一水合氨的电离是微量的,所以C项错误,即答案为C项。
1.弱酸溶液:
[例1]在0.1mol/L的H2S溶液中,下列关系错误的是( )
A.c(H+)=c(HS-)+c(S2-)+c(OH-) B.c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(H+)>[c(HS-)+c(S2-)+c(OH-)] D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
分析:由于H2S溶液中存在下列平衡:H2S 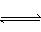 H++HS-,HS-
H++HS-,HS-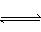 H++S2-,H2O
H++S2-,H2O H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。(注意:解答这类题目主要抓住弱酸的电离平衡。)
H++OH-,根据电荷守恒得c(H+)=c(HS-)+2c(S2-)+c(OH-),由物料守恒得c(H2S)+c(HS-)+c(S2-)=0.1mol/L,所以关系式错误的是A项。(注意:解答这类题目主要抓住弱酸的电离平衡。)
3、分清他们的主要地位和次要地位
[常见题型]
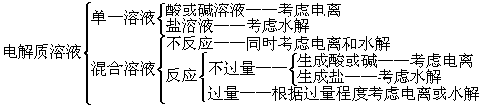
2、掌握解此类题的三个思维基点:电离、水解和守恒
1、必须有正确的思路:
3.导出式--质子守恒:
如碳酸钠溶液中由电荷守恒和物料守恒将Na+离子消掉可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。可以用图示分析如下:
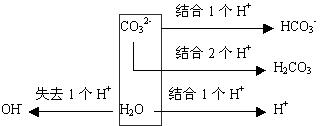 ,由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。
,由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。
又如醋酸钠溶液中由电荷守恒和物料守恒将钠离子消掉可得:c(OH-)=c(H+)+c(CH3COOH)。
[规律总结]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com