
题目列表(包括答案和解析)
10.如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡,小心地从烧杯中央滴入CuSO4溶液。片刻后可观察到的现象是
( )
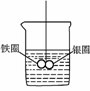
A.铁圈和银圈左右摇摆不定
B.保持平衡
C.铁圈向下倾斜
D.银圈向下倾斜
[解析] 铁圈和银圈两种活动性不同的金属相互连接组成闭合回路,放入CuSO4溶液中,构成了原电池,活泼金属铁作负极失电子生成Fe2+进入溶液中质量减轻:Fe-→Fe2++2e-,电子传给了银圈,溶液中的Cu2+在银圈上得电子生成铜单质而增重:Cu2++2e--→Cu,所以铁圈向上倾斜,银圈向下倾斜。
[答案] D
9.(2010年丽水质检)原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
( )
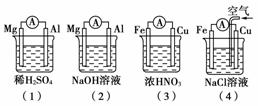
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为:6H2O+6e--→6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为:Fe-→Fe2++2e-
D.(4)中Cu作正极,电极反应式为:2H++2e--→H2↑
[解析] (1)中镁作负极,(2)中铝作负极,(3)中铜作负极,(4)中铁作负极,故A不正确;选项中D中,Cu作正极,但由于通入O2,所以电极反应式为:O2+2H2O+4e--→4OH-。
[答案] B
8.碱性锌锰电池工作时的化学方程式为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。关于碱性锌锰电池的说法正确的是
( )
A.碱性锌锰电池是二次电池
B.正极反应式为:MnO2+H2O+e--→MnOOH+OH-
C.连续工作后的碱性锌锰电池中电解液的pH将减小
D.工作中,每转移0.2 mol电子时,负极质量减轻6.5 g
[解析] 碱性锌锰电池是一次电池,使用完毕后不能进行充电,A错。从总反应方程式可知,反应中消耗了水,因此溶液中OH-浓度增大,pH将增大,C错。该电池负极反应式为Zn-2e-+2OH--→Zn(OH)2,可知负极的质量增加,D错。
[答案] B
7.(2010年泰安质检)将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池,下列叙述正确的是
( )
①通入CH4的电极为正极;②正极的电极反应是O2+2H2O+4e--→4OH-;③通入CH4的电极反应式是CH4+2O2+4e--→CO2+2H2O;④负极的电极反应式是CH4+10OH--→CO+7H2O+8e-;⑤放电时溶液中的阳离子向负极移动;⑥放电时溶液中的阴离子向负极移动。
A.①③⑤ B.②④⑥
C.④⑤⑥ D.①②③
[解析] 据题意知发生的反应为CH4+2O2===CO2+2H2O,反应产生的CO2,处于KOH溶液中,又会转化为CO,故④是正确的。③O2得e-被还原,作正极。④溶液中离子移动情况受溶液(原电池内电路)中电流方向影响,内电路电流方向是由负极流向正极,阳离子的运动方向与电流方向相同,故在溶液(原电池内电路)中阳离子向正极移动,阴离子向负极移动。
[答案] B
6.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是
( )
A.正极反应为:O2+2H2O+4e--→4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
[解析] 此电池在工作时,电子是由铝电极沿导线流向铂电极的,电流方向是电子流动的反方向,应是由铂电极沿导线流向铝电极。
[答案] B
5.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
( )
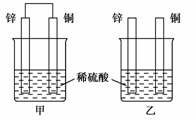
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
[解析] 本题考查了置换反应和原电池原理的有关知识,甲中构成了铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为Zn+H2SO4===ZnSO4+H2↑,原电池的构成加快了反应速率;乙中发生置换反应Zn+H2SO4===ZnSO4+H2↑,所以C正确。
[答案] C
4.电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
[解析] 因为锌锰干电池中锌棒为负极,锌棒变细,碳棒不变,故A错;原电池是将化学能直接转变为电能,所以B错;氢氧燃料电池负极反应为H2-→2H++2e-,所以C正确;太阳能电池采用硅材料制作,D错误。
[答案] C
3.下图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
( )
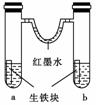
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-→Fe2++2e-
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
[解析] 生铁中的铁、碳与电解质溶液构成原电池,铁块a为中性环境,发生吸氧腐蚀,氧气被消耗,气体压强减小;b中酸性较强,发生析氢腐蚀,有氢气放出,气体压强增大,所以红墨水柱两边的液面变为左高右低,故B项错。
[答案] B
2.(2008年海南高考)关于铅蓄电池的说法正确的是
( )
A.在放电时,正极发生的反应是Pb(s)+SO(aq)-→PbSO4(s)+2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e--→Pb(s)+SO(aq)
[解析] A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO+2e--→PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生氧化反应。
[答案] B
1.下列有关金属腐蚀与防护的说法正确的是(多选)
( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
[解析] 纯银器表面在空气中易形成硫化银而使银器表面变黑,所以是化学腐蚀,A正确;铁与锡构成原电池,铁作负极,加快了铁的腐蚀,B错;海轮外壳中的铁与连接的锌块构成原电池,锌作负极,可以保护海轮,C正确;外加直流电源保护器件时,必须连接电源负极,D错。
[答案] AC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com