
题目列表(包括答案和解析)
2.(18分)下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略。
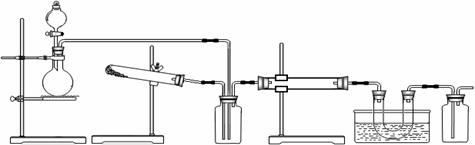
A B C D E F
甲同学认为此套装置用于合成物质X, D处盛放V2O5,E处冰水冷却的U型管中有固体X出现。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是 ,C装置中盛放的液体药品是 。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量。要知道A、B两个装置产物的通入量哪个大,可通过观察
得知。
(3)F装置中盛放的药品是 。本实验有无不妥之处?如有请答出改进方案;若无,此问可不答: 。
乙同学认为此套装置用于合成物质Y,D处盛放铂铑合金网,E处冰水冷却的U型管中有红棕色气体Y生成且越接近U型管底部颜色越浅。对于A处,乙认为没有加热装置。
(4)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时最初所起作用一致,那么C处的广口瓶应改为 ,所装药品为 。
(5)写出乙同学认为的D装置中发生反应的化学方程式
。
(6)为什么此时U型管中的红棕色气体越接近管底颜色越浅?
。
1.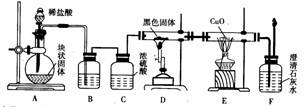 (17分)某校学生课外活动小组的同学设计如下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题:
(17分)某校学生课外活动小组的同学设计如下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题:
(1)装置B中最适宜的试剂是 ,其作用是
(2)装置C的作用是
,若实验中没有装置C,则不可以证明 具有还原性,原因是:
具有还原性,原因是:
(3)装置D中黑色固体为 ,反应的化学方程式为
(4)根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是
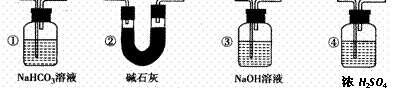
(5)若要根据装置F中出现的现象确认一氧化碳具有还原性,应在上图装置
与 之间连接下图中的 装置(填序号)。
5.(17分)
某化学课外活动小组在实验室做了如下一系列实验:
(1)该小组设计了如图所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性。
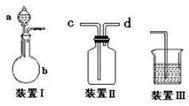
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入 或 ,装置Ⅱ从 管口进气即可作为排气法收集O2的装置。
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法 。
(2)该小组从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol·L-1NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol·L-1的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液
d.滤液中注入2 mol·L-1的硫酸,使其pH保持为2
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
|
pH |
1.5~3.2 |
6.4~8.0 |
①步骤a中用pH试纸控制溶液pH=8,使用pH试纸的操作是 ;步骤b中如何检验沉淀已经洗涤干净 。
②要制得ZnSO4·7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐仪器是 。
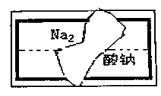 (3)小组在整理实验室的化学试剂时,
(3)小组在整理实验室的化学试剂时,
发现一盛有 无色溶液的试剂瓶。
标签破损(如图),请你根 据已
掌握的知识,对该试剂可能是什
么物质的溶 液作出二种猜想,并
设计实验验证,写出任一种 的实
验操作、现象和结论。
|
|
猜想物质的化学式 |
检验所需要的试剂 |
操作、现象和结论 |
|
① |
|
|
|
|
② |
|
|
|
4.(19分)2008年9月,中国的三聚氰胺污染牛奶事件,在社会上造成了很坏的影响。牛奶和奶粉中添加三聚氰胺主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。请回答下列问题:

(1)产生的氧气按从左到右流向,所选择装置各导管的连接顺序是(要求:先用B、后用C):
g接 、 接 、 接 、 接 。
(2)装置B的作用是 ;
装置E中CuO的作用是 ;
装置D中的化学方程式是 。
(3)实验前后称得A、C两装置的质量分别增加2.64g和1.08g,已知三聚氰胺的相对分子质量为126,则三聚氰胺的分子式为 。又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,试写出三聚氰胺的结构简式 。
(4)目前较多采用尿素[CO(NH2)2]为原料,在一定条件合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式 。
(5)按(1)的连接方法,此实验装置存在的缺点是 ;原因是 。
3.(16分)依据现行高三化学教材习题:“固体 和
和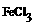 混合物中含有少量
混合物中含有少量 和
和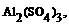 请设计实验进行分离,以得到纯净的
请设计实验进行分离,以得到纯净的 和
和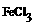 。”图甲是某同学设计并进行的实验:
。”图甲是某同学设计并进行的实验:
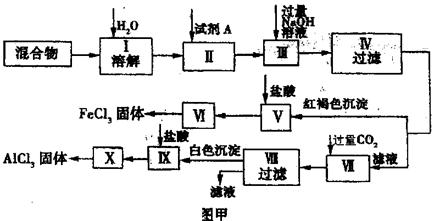
(1)实验操作Ⅱ需加入适宜的试剂,你认为最好选用的试剂是 。
 溶液 B.硝酸
溶液 B.硝酸 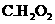 D.浓硫酸
D.浓硫酸
(2)操作V的离子方程式为 ___;
操作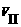 的离子方程式为
.
的离子方程式为
.
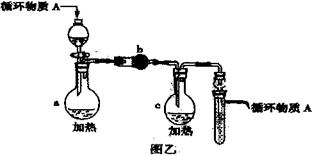 (3)图乙是操作VI、X制取无水
(3)图乙是操作VI、X制取无水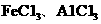 的部分装置(铁架台、加热装置等已略去)。
的部分装置(铁架台、加热装置等已略去)。
①图乙中,装置a由_ _、圆底烧瓶、双孔塞和导管组成。
②循环物质A是 。
③装置b中填充的物质可以是___ _ (填编号)。
A.碱石灰 B.无水氯化钙
C.浓硫酸 D.五氧化二磷
(4)你认为该同学的实验最后 (填“能”或“不能”)得到纯净的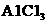 和
和 。
。
若不能,请你完善该同学的实验步骤设计并简述该步骤的操作:
(若能则此空不填)。
1.(16分)某课外小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取一氧化氮的离子方程式 。
|
 (2)查资料得知,HCOOH CO↑+H2O。实验室有如图1所示的装置,制取氧化碳可选用的装置为
(填序号)。
(2)查资料得知,HCOOH CO↑+H2O。实验室有如图1所示的装置,制取氧化碳可选用的装置为
(填序号)。
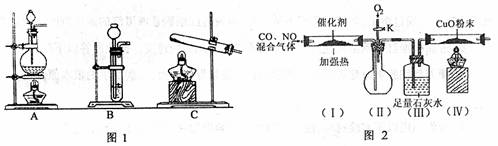 (3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氨氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氨氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。
①实验前关闭旋塞K,先通氮气排净装置中的空气,其目的是 。
②装置(Ⅲ)的主要作用 ,
③加热停止后,打开旋塞K,放人适量氧气时,装置(Ⅱ)中可观察到的现象是 。
④该套装置中有不完善之处.还应在装置(Ⅳ)后补充 。
(4)图3中A是镁在CO2中燃烧的实验装置,化学反应方程式是 ;镁在SO2中也可发生类似的反应.实验在如图3B装置中进行,其中K1是缠绕镁条的电热丝,通电后引燃,B装置的优点是 ;B中观察到的实验现象是 。
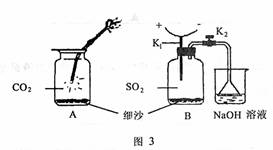 (5)l g镁与水反应放出14.7kJ热量,该反应的热化学方程式是
。
(5)l g镁与水反应放出14.7kJ热量,该反应的热化学方程式是
。
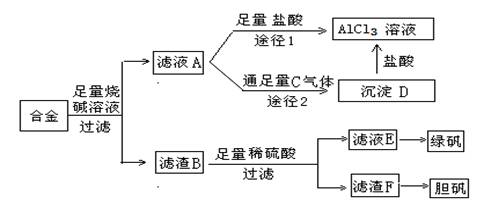 2.某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验过程如下:
2.某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验过程如下:
(1)由滤液A制AlCl3溶液的途径有两条(如上图示),你认为合理的途径是_____,理由是__ __。
(2)下表是绿矾的溶解度表:(单位克)
|
温度(℃) |
10 |
20 |
30 |
40 |
50 |
|
溶解度 |
36 |
48 |
60 |
73 |
87 |
从滤液E中得到绿矾晶体的实验操作为_________ 、__________、过滤。此步骤中过滤要采用抽滤,与一般过滤相比抽滤的主要优点是_____________________。但过滤氢氧化铝沉淀却不能采用抽滤,原因可能是_____________________________。
(3)在滤渣B中加入稀硫酸,即使在常温下反应也非常快,你认为最主要的原因是_______ _____________________________。
(4)该小组某成员听说大部分化妆品中均有甘油,仅用上面涉及的物质,能否验证某化妆品中是否含有甘油?___________(能或不能)。若能,验证是否含甘油的现象是________________________________。
(5)为了得到纯度更高的胆矾,上面制得的晶体需用乙醇加以洗涤,用乙醇洗比用水好,原因是______________________________________________________________。
4.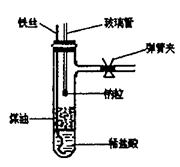 (15分)有人设计了如右制备氢氧化亚铁的改进实验:
(15分)有人设计了如右制备氢氧化亚铁的改进实验:
(I)按右图所示组装仪器;向一支小的具支试管中
加入2mL左右稀盐酸,再加入2mL左右的煤
油;玻璃管下端粘住钠粒(用滤纸吸干表面煤
油,切去氧化层)。
(II)将铁丝浸入盐酸,反应放出氢气,待试管内空
气排尽后,向上提拉铁丝,使铁丝脱离液面。
并关闭弹簧夹;用另一根细铁丝沿玻璃管内将
钠粒捣入液体中。
请回答下列问题:
(1)写出该实验中发生反应的化学方程式:
(2)如何检验试管内空气已排尽(回答具体操作)?
(3)捣入钠粒后,预测具支试管中的现象:
(4)已知钠粒的质量约0.05 g,现实验室有以下两种不同浓度的盐酸,你选择(填A或B)
A.1.1mol/L B.10 mol/L
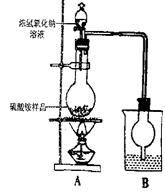 5.(16分)某校化学研究性小组为了测定硫酸铵样品中(含
5.(16分)某校化学研究性小组为了测定硫酸铵样品中(含
杂质NaCl)硫酸铵的质量分数按右图装置进行实验。
(1)烧瓶内发生反应的离子方程式为
:
(2)烧杯中盛放的试剂最好是 (填序号)
a浓硫酸 b稀硫酸 C、水
理由是 。
(3)但有同学对此实验提出质疑,甲同学认为此实验
所测得的硫酸铵的质量分数可能偏高,因为实验
室装置存在一个明显缺陷是 ;
乙同学认为该实验还存在另一个明显缺陷是 。针对甲、乙两位同学提出的实验装置中存在的明显缺陷,大家将该实验装置改进,重新进行实验,称取16.5硫酸铵样品,测得实验后B装置增重3.4g,那么该样品中硫酸铵的质量分数为 ;
(4)还可用其它方法测定样品中的硫酸铵的质量分数,请简述一种不同的实验方法。
。
3.(14分)下面是某化学学习小组的同学进行探究草酸晶体受热分解的产物和利用产物进行实验的过程,请你参与并协助他们完成相关学习任务。
[查阅资料]
该小组同学通过网络查询,获得草酸及草酸晶体的一些相关知识:
|
名称 |
分子式 |
颜色、状态 |
溶解性 |
熔点(℃) |
密度(g/cm3) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
1.900 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
|
101.5 |
1.600 |
备注:草酸晶体175℃以上开始分解
[提出猜想]
(1)草酸分解产物中有水;
(2)草酸分解产物中的气体可能是CO、CO2或它们的混合物。
[设计方案]
化学学习小组的同学经过讨论,设计了下图所示的装置进行“猜想”的实验探究并进行某经处理后赤铁矿石样品的测定。已知:A中装有草酸晶体,8中装有碱石灰,c中装有FxOy样品,D中盛装足量的澄清石灰水。
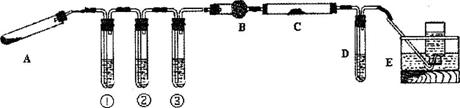
[讨论与交流]
(1)上图A是用来加热草酸晶体并验证“猜想(1)”的。小华认为该装置错误,正确应是试管口略向下倾斜的,你的判断和理由是_____________________。
(2)若要证明分解产物中有CO:,并能完成后续实验,装置①②③中所盛装的试剂分别是
①___________________,②________________,③__________________________。
(3)证明分解产物中有CO的现象是__________________________________________。
(4)反应完全后,该组同学进行数据处理。反应前,称得硬质玻璃管的质量为54.00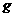 ,样品FxOy的质量为7.84
,样品FxOy的质量为7.84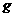 ;反应后,称得硬质玻璃管与剩余固体的总质量为59.60
;反应后,称得硬质玻璃管与剩余固体的总质量为59.60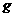 (其质量经同样操作后也不再发生变化),则样品FxOy,中,x:y=___________
(其质量经同样操作后也不再发生变化),则样品FxOy,中,x:y=___________
(5)E装置的作用是什么,还有什么不同的处理方法_________________________。
2.(14分)某课外活动小组同学欲用右图装置测定镁的相
对原子质量(固定装置未画出)。
操作步骤是:
①准确称取已除去氧化膜的镁条。
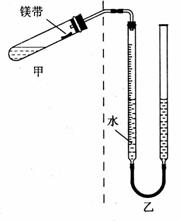 ②按右图所示装配好仪器。往量气管内装水至低于
②按右图所示装配好仪器。往量气管内装水至低于
刻度“0”的位置。
③检查装置气密性。
④用漏斗将5 mL 2 mol/L硫酸(足量)注入试管中,
稍倾斜试管,将用水湿润的镁条小心贴在试管壁
上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量
气管中液面位置。
⑥把试管底部略为抬高,使镁条与稀硫酸接触反应。调整
……记录量气管中液面位置。
⑦测得室内温度与大气压为:20℃,1.01×105Pa
(已知条件下的Vm=24.0L/mol)
(1)镁条与稀硫酸反应的离子方程式为
,该反应的反应热 0(填>、<、=)。
0(填>、<、=)。
(2)在不能改变温度的条件下,如何用较简单的方法检查上图装置的气密性?
(3)乙装置中左侧的量气管是用25 mL的碱式滴定管代替的,则镁条的质量应不超过
g(保留两位有效数字),能否用托盘天平称量镁条 (填写
“能”或“否”)。
(4)某同学在读出量气管中液面位置时,步骤⑤仰视,步骤⑥俯视,将会使测得的镁的相对原子质量 (填“偏高”、“偏低”或“无影响”)。
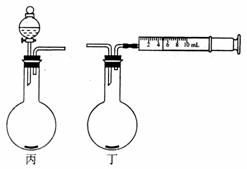
(5)同学们在实验操作中发现步骤④不易成功,镁条常常在步骤⑤未完成时就滑入试管中与硫酸接触。为改进装置,有同学设计了丙、丁装置欲代替上图中的甲。经过讨论,大家一致认为选用丁更好。不宜选用丙的主要原因是
。
1.(18分)根据以下各物质间的转化关系回答有关问题。
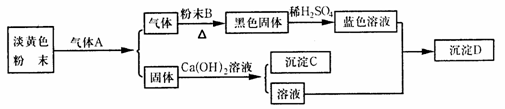
(1)B、C、D的化学式依次为_____________、___________、____________。
(2)A的电子式为_______,它属于____________(填“极性”或“非极性”)分子。
(3)淡黄色粉末与气体A反应的化学方程式为___________________________;黑色固体与稀硫酸反应的离子方程式为__________________。
(4)下图为中学化学实验室常用的部分装置或仪器,请填写有关空白。
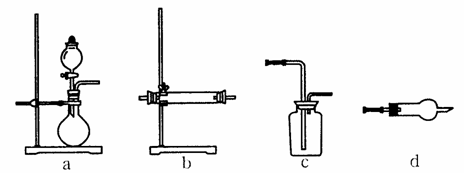
①淡黄色粉末与气体A的反应,可以选择在上述装置___________(填字母代号,下同)中进行;气体与粉末B的反应可选用上述装置中的____________作反应发生装置。
②实验室通常用沉淀C和_______________反应制取气体A;制取时的反应装置应选用上述装置中的_____________________;若要用浓硫酸干燥制得的气体A,应选用上述装置中的__________作干燥装置。
③请写出装置d在中学化学实验中的可能用途(写出两条即可)_____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com