
题目列表(包括答案和解析)
25. (2009年高考福建卷)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
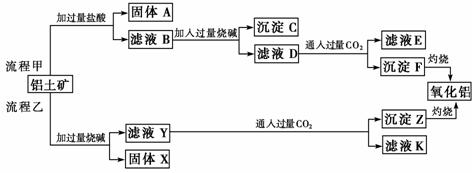
请回答下列问题:
(1) 流程甲加入盐酸后生成Al3+的离子方程式为______________。
(2) 流程乙加入烧碱后生成SiO32-的离子方程式为_________________________。
(3) 验证滤液B含Fe3+,可取少量滤液并加入_____________(填试剂名称)。
(4) 滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途____________________________________________。
(5) 已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=________________。
金属及其化合物答案
1-5、DCACA 6-10、DDBCD 11-15、CCBCD 16-20、ACBDB
24. A.B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1 mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A、B、E的化学式:
A ________ 、B _________、E ___________。
(2)写出③和④的离子方程式:
③ _____________________________________________________;
④ _____________________________________________________。
23.由短周期元素组成的A、B两种盐可发生下列变化.且B的焰色反应呈黄色(图中其它生成物未列出)
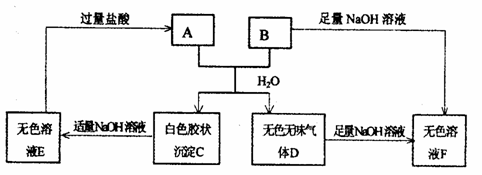
(1)A和B的混合物溶于水发生反应的离子方程式_____________________
(2)B、E两溶液混合反应时,可观察到的现象是_________________________,
写出B→F反应的离子方程式________________
22.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式 。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04 . 5H20) 。经查阅资料得知 ,在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
实验小组设计如下实验方案:
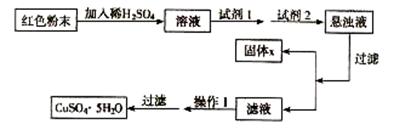
试回答:
① 试剂I为 ,试剂II为 (填字母)。
② 固体X的化学式为 。
③ 操作I为 。
21.下图是部分元素的单质及其化合物的转化关系图(有关反应的条件己略去);己知:
B.C、G、L 均为单质,其中在常温、常压下,G是固体,B、C、L是气体;生成物E具有漂白性,且焰色反应呈黄色;F 在常温下是液体;K、M 均为不溶于水的沉淀,其中K 为红褐色。
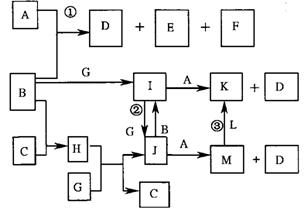
请回答下列问题:
(l) D的电子式:____________________________;
(2) 反应①的离子方程式是____________________________;
(3) 反应②的离子方程式是____________________________;
(4) 反应③的化学方程式是___________________________________;
(5) 保存J溶液时还需加入___________________________________。
(6) 实验室由J制备少量M 的方法:用胶头滴管吸取A溶液,将滴管尖端插入盛有新制J溶液试管底部,慢慢挤出A 溶液即可,观察到的现象为:
;这样操作的理由是
20.(2009年高考台湾卷)下表所列为五种可溶性盐在30 ℃的溶解度(g/100 g H2O):
|
盐 |
NaCl |
NaHCO3 |
Na2CO3 |
NH4Cl |
|
溶解度 |
36.5 |
12.1 |
30.0 |
41.1 |
若在30 ℃的饱和食盐水中通入氨气至饱和后,再通入二氧化碳就会有晶体析出。试参考表中的数据,推测析出的晶体是下列的哪一种( )
A.NaCl B.NaHCO3 C.Na2CO3 D. NH4Cl
19.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中: 2Al+2OH-===2[Al(OH)4]-+H2↑
B.AlCl3溶液中加入足量的氨水: Al3++3OH-===Al(OH)3↓
C.三氯化铁溶液中加入铁粉: Fe3++Fe===2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
18.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉淀、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
17.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是 ( )
A.35g B.30 g C.20 g D.15 g
16.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是 ( )
|
|
Na |
Cu |
Al |
Fe |
|
熔点 |
97.5℃ |
1083℃ |
660℃ |
1535℃ |
|
沸点 |
883℃ |
2595℃ |
2200℃ |
3000℃ |
A.Cu和Na B.Fe与Cu C.Fe与Al D.Al与Na
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com