
题目列表(包括答案和解析)
2.将足量的CO2通入含有KOH和Ca(OH)2各0.1mol的混合稀溶液中,试作出生成沉淀的物质的量(n)和通入CO2气体的体积(V)的关系图:
思维方法: 。
展望高考:
[针对训练]
A.基础训练
.





 Si O2
Ca(HCO3)2
CaCO3
Si O2
Ca(HCO3)2
CaCO3








 SiC
C
CO2
Na2CO3
SiC
C
CO2
Na2CO3




 SiO2
CO
Fe
MgO
NaHCO3
SiO2
CO
Fe
MgO
NaHCO3
[例题解析]
[例1] 门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期第ⅣA族元素X(当时称为类硅)。下列有关类硅的元素性质,不正确的是( )
A.XH4不稳定,但有强还原性 B.可用焦炭在高温下从XO2中冶炼X
C.X单质的熔点比硅高 D.X(OH)4的酸性比H2SiO3强
解题思路: 。
易错点: 。
[例2] 最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60,下列说法正确的是( )
A.C60是一种新型的化合物 B.C60和石墨都是碳的同素异形体
C.与C60结构类似的还有C60分子 D.C60的相对分子质量是720g/mol
解题思路: 。
易错点: 。
[考题再现]
1. 等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原来的8/9(同温同压),则反应后所得混合气体中N2、O2、CO2物质的量之比为
A. 3:4:1 B.3:3:2 C.6:7:3 D. 6:9:0
思维方法: 。
展望高考:
3. 含碳化合物:
(1)CO2:物理性质 ;
化学性质 ;
实验室制法:原料 、
原理 、
装置 、
步骤 。
(2)CO:物理性质 ;
化学性质 ;
实验室制法:原料 、
原理 、
装置 ;
(3)碳酸正盐:稳定性 、
溶解性 ;
(4)酸式盐:稳定性 、
溶解性 ;
(5)其它含碳化合物、有机化合物、金属碳化物
候氏制碱法的主要反应中用到上述哪些物质中的哪些性质?
。
2. 碳单质:
(1)同素异形体: ;
无定形碳: 。
(2)性质:稳定性 ,比如 ;
还原性:
;
可燃性: ;
弱氧化性: 。
1. 碳族元素:
(1)在周期表中的位置 (由原子结构中的 决定)。
(2)包含元素的名称、符号、原子结构简图、原子半径、化合价等比较
元素名称 元素符号 原子结构简图 原子半径 化合价 单质性质变化
碳
硅
锗
锡
铅
(3)相似性: 、
(4)递变性: 。
(5)特殊性:难形成离子化合物,易形成共价化合物。
(6)用原子结构知识解释(3)(4)(5):
。
25、 (1) Al2O3+6H+===2Al3++3H2O
(2) SiO2+2OH-===SiO32-+H2O
(3) 硫氰化钾(或硫氰酸钾、苯酚溶液等)
(4) NaHCO3 制纯碱或作发酵粉等
(5) 5.6×10-10 mol·L-1
24、 (1) Na2CO3 AgNO3 Ba(OH)2
(2) ③2Fe3++Fe===3Fe2+ ④Al3++4OH-===[Al(OH)4]-
23、(1)Al3++3HCO3-==== Al(OH)3↓+3CO2↑
(2) 生成白色胶状沉淀 HCO3-+OH-====CO32-+H2O
22、(1)溶液变为血红色
(2)不合理 Cu能将Fe3+还原为Fe2+
(3)Fe2O3和Cu2O的混合物 Fe2O3+6H+ = 2Fe3++3H2O
Cu2O+2H+
= Cu + Cu2+ + H2O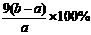 2 Fe3+ + Cu = 2 Fe2+ + Cu2+
2 Fe3+ + Cu = 2 Fe2+ + Cu2+
(4)
(5)① B D ② Fe(OH)3 ③ 加热蒸发
21、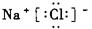 ⑴
⑴
(2) Cl2 +2OH- ===ClO- +C1-+H2O
(3) Fe +2Fe3+ ===3Fe2+
(4) 4Fe(OH)2 +O2 +2H2O=== 4Fe(OH)3↓
(5) 稀HC1 铁屑
(6) 开始析出一种白色的絮状沉淀,然后迅速变成灰绿色,最后变成红褐色;
避免生成的Fe(OH)2沉淀接触O2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com