
题目列表(包括答案和解析)
6.臭氧的性质:
(1)物理性质:在常温常压下,臭氧是一种有 的 色
体,密度比氧气 , 溶于水;液态臭氧呈 色,固态臭氧呈 色。
(2)化学性质:
①极强的氧化性:O 3 +KI + H2O =
②不稳定性:
③漂白性:漂白原理是依靠 性,因此臭氧是一种很好的 剂和 剂;
④产生方式: (用化学方程式表示)
5. 硫的四种价态间的含硫物质之间的网络关系
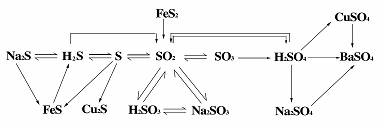
 ①H2S是具有臭蛋气味的剧毒气体,其水溶液--氢硫酸是一种具有挥发性的二元弱酸,硫化氢、氢硫酸都具有强还原性可被碘水、溴水、氯水、FeCl3溶液、HNO3等氧化。H2S能燃烧,燃烧依反应条件不同而不同。
①H2S是具有臭蛋气味的剧毒气体,其水溶液--氢硫酸是一种具有挥发性的二元弱酸,硫化氢、氢硫酸都具有强还原性可被碘水、溴水、氯水、FeCl3溶液、HNO3等氧化。H2S能燃烧,燃烧依反应条件不同而不同。
②硫与Fe、Cu反应时,由于其非金属性比氯弱,所以生成低价态的物质FeS、Cu2S。
③硫的氧化物有SO2和SO3,其中SO2是一种有刺激气味的气体,易液化,易溶于水--其水溶液叫亚硫酸、二元弱酸。SO2是重要的大气污染物(其危害详见课本),防治方法有排烟除硫燃料脱硫。
4.硫单质与氢化物、氧化物的性质及化合价关系
强还原性 氧化性、还原性 强氧化性

特别注意:中间价态的两类硫既有氧化性,又有还原性,SO2、H2SO3、Na2SO3以还
原性为主。
3.金属硫化物的颜色和溶解性
2.硫的氢化物、氧化物及其水化物的结构、性质
|
|
氢化物 |
氧化物 |
氧化物水化物 |
|||
|
结 构 |
分子式 |
H2S |
SO2 |
SO3 |
H2SO3 |
H2SO4 |
|
化学键 |
|
|
|
|
|
|
|
晶体类型 |
|
|
|
|
|
|
|
物 理性质 |
色、味、态 |
|
|
|
|
|
|
毒性 |
|
|
|
|
|
|
|
化 学 性质 |
溶解性 |
|
|
|
|
|
|
与金属反应 |
|
不反应 |
不反应 |
|
|
|
|
稳定性 |
不稳定 |
稳定 |
较稳定 |
不稳定 |
稳定 |
|
|
水溶液的酸性强弱 |
弱酸性 |
|
|
|
|
|
|
检 验 |
使含Pb2+的湿润试纸变黑或与Cu2+反应生成CuS沉淀 |
|
|
|
|
1.氧族元素的原子结构及性质递变规律
|
|
氧(O) |
硫(S) |
 硒(Se) 硒(Se) |
碲(Te) |
|||||||
|
原子结构 |
原子序数 |
|
|
|
|
||||||
|
结构示意图 |
|
|
|
|
|||||||
|
电子式 |
|
|
|
|
|||||||
|
主要化合价 |
|
|
|
|
|||||||
|
相同点 |
|
||||||||||
|
不同点 |
|
||||||||||
|
|
|
||||||||||
|
原子半径 |
|
||||||||||
|
物 理 |
颜色和状态 |
|
|
|
|
||||||
|
密度 |
|
||||||||||
|
性 质 |
熔、沸点 |
|
|||||||||
|
水、有机溶剂溶解度 |
|
||||||||||
|
化学反应 |
与金属反应 |
|
|
|
|
||||||
|
与非金属 反应 |
|
|
|
|
|||||||
|
与化合物 反应 |
|
|
|
|
|||||||
[小结]
非金属性依次 ;金属性依次 。
3. 了解硫的氧化物对环境的污染及环境保护的意义
教与学方案
[自学反馈]
2. 以硫元素为代表,了解氧族元素的单质、氢化物及其氧化物的重要性质;
1.理解氧族元素的性质递变规律;
19、用图3-5所示的实验过程,测定含Na2SO3的亚硫酸钠中Na2SO3的质量分数(Na:23克/摩;Ba:137克/摩;S:32克/摩).

图3-5
测定沉淀乙(纯净干燥)的质量W1g,试回答:
(1)试剂A溶液是 ,检验A稍过量的方法是 ;
(2)试剂B溶液是 ,B的作用是 ;
(3)沉淀甲的化学式是 ,沉淀 乙的化学式是 ;
(4)沉淀甲与B反应的离子方程式是 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com