
题目列表(包括答案和解析)
5.分子间作用力:
(1)概念: 。
(2)影响因素: 。
(3)对物质性的影响: 。
4.非极性分子:
(1)含义: 。
(2)判断方法:①根据键角判断分子中的正负电荷重心是否重叠
②根据ABn的中心原子A周围是否为完全等价的电子对
③根据ABn的中心原子A的最外层价电子是否全部参与形成
了同样的共价键。(或A是否达最高价)
(3)常见ABn型分子中极性分子与非极性分子比较:
分子类型 举例 键角 构形 分子极性
AB CO
AB2(A2B) H2O
CS2
BeCl2
AB3 PCl3
BF3
SO3
AB4 CH4
AB2C2 CH2Cl2
A2B4 C2H4
A2B2 C2H2
A6B6 C6H6
3.极性分子:
(1)含义: 。
(2)举例: 。
2.极性键:
(1)概念: 。
(2)形成条件: 。
(3)共价键极性强弱比较依据:形成共价键的共用电子对偏向与偏离程度越
大,键的极性就越强。试比较下列两组共价键的强弱:
①H-H、H-F、H-O、H-N、H-C: ;
②H-F、C-F、N-F、O-F、F-F: 。
1.非极性键:
(1)概念: 。
(2)形成条件: 。
20. 某离子晶体中晶体结构最小的重复单元(晶胞)如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
某离子晶体中晶体结构最小的重复单元(晶胞)如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A、B2A B、BA2
C、B7A4 D、B4A7
19. 表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同)________,金刚石中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体;
(2)其中代表石墨是________,其中每个正六边形占有的碳原子数平均为________个;
(3)其中表示NaCl的是_____,每个Na+周围与它最接近且距离相等的Na+有_____个;
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻;
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻;
(6)上述五种物质熔点由高到低的排列顺序为________。
D.奥赛一瞥
18.将HCl、HF、CH4、NH3、H2O、MgO、SiO2、CO2、NaCl、NaOH等化合物按要求填空:
(1)属于离子化合物的是__ _,其中只有离子键的化合物的电子式为______、______;
(2)属于分子晶体的氧化物是________,属于原子晶体的氧化物是________;
(3)具有四面体构型的化合物是________,键角略大于90 的化合物是________,难溶于水的气态氢化物是________,难溶于水的氧化物是________。
的化合物是________,难溶于水的气态氢化物是________,难溶于水的氧化物是________。
17.在 mol金刚石中含C-C键数为( )
mol金刚石中含C-C键数为( )
A. B.
B.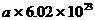
C. D.
D.
16.下表中列出了有关晶体的说明,有错误的是( )
|
选项 |
A |
B |
C |
D |
|
晶体名称 |
碘化钾 |
干冰 |
石墨 |
碘 |
|
组成晶体微粒名称 |
阴、阳离子 |
分子 |
原子 |
分子 |
|
晶体内存在的结合力 |
离子键 |
范德华力 |
共价键 |
范德华力 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com