
题目列表(包括答案和解析)
2.元素R的最高价含氧酸的化学式为HnRO2n-2,则在气态氢化物中,R元素的化合价为( )
A.12-3n B.3n-12 C.3n-10 D.6-3n
1.已知X、Y均为1-18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则这两种元素的原子序数之和为 ( )
A.19 B.18 C.16 D.9
2. A+、B―、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B―在加热时相互反应可转化为C和D。则B-的电子式为 ,A+的电子式为 。
思维方法: 。
展望高考:
[针对训练]
A.基础训练
1.(全国高考题)甲乙是周期表中同一主族的两种元素,若甲的原子序数是x ,
则乙的原子序数不可能是 ( )
A.x+2 B.x+4 C.x+8 D.x+18
思维方法: 。
展望高考:
3.左上右下对角线元素的性质 ,催化剂通常在 元素及其化合物中寻找,半导体材料通常在 元素中寻找,研制新农药通常在
元素的化合物中进行研究。
.[例题解析]
[例1] 已知An+、B(n-1)+、C(n+1)+、D(n+1) - 都有相同的电子层结构,A、B、C、D的原子半径由大到小的顺序是( )
A.C>D>B>A B.A>B>C>D
C.B>A>C>D D.A>B>D>C
解题思路: 。
易错点: 。
[例2]已知aA与bB是同主族的两种相邻元素,又知A元素所在周期共有
m种元素,B元素所在周期共有n种元素,若a>b,则b的值可能为
;若a<b,则b的值可能为 。
解题思路: 。
易错点: 。
[考题再现]
2.同主族元素从上到下:随着 的递增,原子半径 ,原子核
对最外层电子的吸引力 ,得电子能力 ,元素的 性
增强,失电子能力 ,元素的 性减弱。具体表现在单质的
性增强, 性减弱;元素的最高价氧化物的水化物的 性增强,
性减弱;气态氢化物的 性增强;……
1.同周期元素从左到右:随着 的递增,原子半径 ,原子核
对最外层电子的吸引力 ,得电子能力 ,元素的 性
增强,失电子能力 ,元素的 性减弱。具体表现在单质的
性增强, 性减弱;元素的最高价氧化物的水化物的 性增强,
性减弱;气态氢化物的 性增强;……
2.元素周期表:
(1)概念: 。
(2)编排规律:
行: 、共有 行;
列: 、共有 列。
(3)结构:
周期: ;
短周期: 、包括 、分别含 种元素;
长周期: 、包括 、分别含 种元素;
不完全周期: 。
族: ;
主族: 、包括 列、用 代表主族。
副族: 、包括 列、用 代表副族。
零族: 、第Ⅷ族: 。
过渡元素: 。
元素所显最高正价与族序数的关系 。
1.元素周期律:
(1)概念: 。
(2)表现形式:
①原子最外层电子排布: ;
②原子半径: ;
③元素的化合价: ;
④ : ;
⑤ : ;
⑥ : ;
其中 是引起元素性质发生周期性变化的本质原因,
而其它性质的周期性变化是 周期性变化的必然结果。
21.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或折开)1mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P198kJ·mol-1、P-O360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1。则P4+3O2=P4O6的反应热△H为
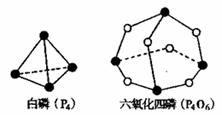
A.+1638kJ·mol-1 B.-1638kJ·mol-1
C.-126kJ·mol-1 D.+126kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com