
题目列表(包括答案和解析)
3. (2008·天津理综,9)醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列
(2008·天津理综,9)醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列
叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶
液的pH<7
 解析:CH3COOH溶液中存在电离平衡CH3COOH H++CH3COO-,由电荷守恒可知c(H+)=c(OH-)+c(CH3COO-);加水稀释时平衡正向移动,但稀释是主要的改变,大于平衡的移动,因此c(H+)减小,由KW=c(OH-)·c(H+),则c(OH-)增大;加入CH3COONa固体平衡逆向移动;D中pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合
解析:CH3COOH溶液中存在电离平衡CH3COOH H++CH3COO-,由电荷守恒可知c(H+)=c(OH-)+c(CH3COO-);加水稀释时平衡正向移动,但稀释是主要的改变,大于平衡的移动,因此c(H+)减小,由KW=c(OH-)·c(H+),则c(OH-)增大;加入CH3COONa固体平衡逆向移动;D中pH=2的CH3COOH溶液和pH=12的NaOH溶液等体积混合
n(CH3COOH)>n(NaOH),则混合液中酸过量(因为CH3COOH为弱酸)pH<7。
答案:B
2.冰醋酸中加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是( )
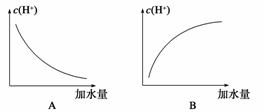
解析:冰醋酸为纯醋酸,没有水作溶剂,难以电离出氢离子。随着水的加入,在极性
试剂作用下:CH3COOHH++CH3COO-。H+浓度不断增加,稀释到一定程度,
成为醋酸的水溶液,则随水的增加,溶液体积变大,虽然电离程度也增加,但体积增
大因素占主要地位,所以溶液中H+的浓度逐渐减小。
答案:C
1.(2009·宁夏理综,11)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶
液有关量或性质的变化趋势,其中错误的是( )
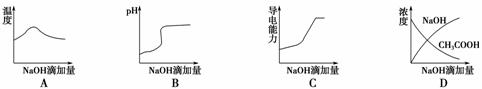
解析:A项开始随NaOH滴加,中和反应放热越来越大,温度逐渐升高,至CH3COOH
反应完全后,放出的热被环境吸收,又呈下降趋势;B项,混合液的pH,随NaOH
加入,由酸性变到中性,到达反应终点时,pH发生突变,再加NaOH,因NaOH溶
液浓度增大,pH呈逐渐增大形状;C选项CH3COOH是弱电解质,导电能力较弱,
加入NaOH后,生成强电解质CH3COONa,导电能力增强;D选项NaOH浓度不
会一直增大,最后呈基本水平走势。
答案:D
9. (1)用简单的实验证明在氨水中存在NH3·H2O NH+OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。
(1)用简单的实验证明在氨水中存在NH3·H2O NH+OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。
________________________________________________________________________
________________________________________________________________________。
(2)老师给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明醋酸是弱酸。
药品为冰醋酸、蒸馏水和pH试纸。此同学思考后认为:
①设计的理论依据是
_____________________________________________________________________;
②实验的简要步骤是
__________________________________________________________________;
③需记录的现象和数据是
________________________________________________________________________;
④推断与分析:由于
________________________________________________________________________,
说明________________,所以醋酸是弱酸。
解析:(1)用实验方式考查弱电解质的电离平衡,需要进行一个简单操作,该操作能产
生明显的变化,通过变化能说明是平衡移动造成的即可。
(2)依据题目所给的相关试剂,分析得出利用弱电解质溶液的稀释所引起离子浓度的变
化进行证明。
答案:(1)在氨水中滴入酚酞试液变红,加入醋酸铵固体,振荡,溶液颜色明显变浅,
说明c(OH-)减小,是c(NH)增大平衡左移而造成的,由此证明氨水中存在着电离平衡
(2)①弱电解质稀释10a倍,pH改变小于a ②将一定浓度的醋酸稀释到一定量(如100
倍)后,测量稀释前后溶液的pH ③稀释的倍数、稀释前后溶液的pH ④溶液稀释100
倍后,溶液的pH改变小于2 稀释过程中醋酸的电离程度增大
8.在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
______________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积
由大到小的顺序是______________。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同
体积的H2(相同状况),则开始时反应速率的大小关系为____________。反应所需时间
的长短关系是__________。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
________________________________________________________________________。
解析:HCl===H++Cl- H2SO4===2H++SO
CH3COOHH++CH3COO-
(1)当三种酸物质的量浓度相同时,三种酸中c(H+)由大到小顺序为b>a>c。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力盐酸和醋酸相同,因随着
NaOH溶液的加入CH3COOH电离平衡右移,提供的氢离子和盐酸相同,而硫酸提供
的H+是它们的2倍,故b>a=c。
(3)c(H+)相同时,醋酸溶液浓度最大,因醋酸为弱酸,电离程度小,硫酸浓度为盐酸的
一半,故c>a>b。
(4)当三者c(H+)相同时,因HCl、H2SO4为强电解质,在溶液中完全电离,所以H+总
的物质的量相同,故产生H2体积相同。CH3COOH为弱电解质,最终能提供的H+最
多,生成H2体积最大。故c>a=b。
(5)开始时由于三者c(H+)相同,故在所给条件下开始生成氢气的速率相同。随着反应的
不断进行,HCl、H2SO4中的H+不断减少,而CH3COOH能不断电离出H+,故产生
等量H2时,醋酸所需时间最短,即所需时间a=b>c。
(6)由于HCl、H2SO4完全电离,加水稀释后,c(H+)减小的程度较大,CH3COOH部分
电离,随着水的加入,使CH3COOH的电离程度增大,稀释相同的倍数,c(H+)减小的
程度较小,故c>a=b。
答案:(1)b>a>c (2)b>a=c (3)c>a>b (4)c>a=b (5)a=b=c a=b>c (6)c>a=b
7.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答下列问题:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA
是强酸还是弱酸
________________________________________________________________________
________________________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L______?
(填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
________________________________________________________________________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______酸(填“强”或“弱”)。该混合溶液中离子浓度
由大到小的顺序是
________________________________________________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=____________mol/L。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=____________mol/L
解析:(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生
成的产物是NaA,对NaA溶液分析,若a=7,说明HA是强酸,若a>7,说明溶液是
因A-的水解而显碱性,则HA是弱酸。
(2)不一定等于0.2。当HA是强酸时等于0.2;当HA是弱酸时,大于0.2。因为pH=7,
说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(Na+)=c(A-)。
(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7,说明A-水解,
得到HA是弱酸,其他易推知。
(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9 mol/L,则由水电离产生的
c(H+)=c(OH-)==10-5 mol/L,由电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(A-),
则c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9) mol/L。
答案:(1)如a=7,HA为强酸,如a>7,则为弱酸 (2)否 C (3)弱 c(Na+)>c(A-)>c
(OH-)>c(H+) (4)10-5 10-5-10-9
6.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.100 0 mol/L的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol/L)为( )
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4===8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008 889 B.0.080 00 C.0.120 0 D.0.240 0
解析:可设NaOH溶液体积为1 L,则KMnO4溶液体积为 L,n(NaOH)=0.100 0 mol/L×
1 L=0.1 mol,n(KHC2O4·H2C2O4·2H2O)=n(NaOH)=×0.1 mol= mol
n(KMnO4)=·n(KHC2O4·H2C2O4·2H2O)=· mol= mol
c(KMnO4)==0.080 00 mol/L
答案:B
5.某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为( )
A.V(酸)=102V(碱) B.V(碱)=102V(酸)
C.V(酸)=2V(碱) D.V(碱)=2V(酸)
解析:强酸中c(H+)=10-a mol·L-1,强碱中c(OH-)= mol·L-1=10-14+b mol·L-1=
10-14+12-a mol·L-1=10-2-a mol·L-1,混合后pH=7,即n(H+)=n(OH-),故V(碱)=102V(酸)。
答案:B
4. 实验中许多量器的结构不一样,使用时要先了解其构造特点,才能尽可能地减少误差,晓明同学用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,请你判断她所用的仪器是( )
A.量筒 B.滴定管 C.容量瓶 D.以上均不对
解析:仰视时读数在平视时读数的下面。量筒0刻度(无)在最下边,x<n。滴定管0刻度在最上面,x>n>y。
答案:B
3.相同温度下,两种氨水A、B,浓度分别是0.2 mol/L和0.1 mol/L,则A和B的OH-
浓度之比( )
A.大于2 B.小于2 C.等于2 D.不能确定
解析:对于氨水的稀溶液,浓度越小,电离程度越大,因此0.2 mol/L氨水的电离
程度比0.1 mol/L氨水的电离程度小,OH-浓度之比小于2。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com