
题目列表(包括答案和解析)
2.下列物质中只含有游离态氯元素的是( )
A.液氯 B.氯水 C.盐酸 D.次氯酸
解析:液氯中只有氯分子;氯水中有H2O、Cl2、HClO、H+、Cl-、ClO-、OH-;盐酸中有H2O、H+、OH-、Cl-;次氯酸为HClO,氯以化合态形式存在。故只有A中只含游离态氯元素。
答案:A
1.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol/L。如果在甲瓶中加入少量的NaHCO3晶体(n mol),在乙瓶中加入少量的NaHSO3晶体(n mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>丙>甲
解析:氯水中存在下列平衡:Cl2+H2O HCl+HClO,加入NaHCO3后,因为酸性:HCl>H2CO3>HClO,所以NaHCO3与HCl反应而不与HClO反应,平衡向右移动,HClO浓度增大;乙瓶中因HClO具有强氧化性,可将NaHSO3氧化,从而使HClO浓度下降。
HCl+HClO,加入NaHCO3后,因为酸性:HCl>H2CO3>HClO,所以NaHCO3与HCl反应而不与HClO反应,平衡向右移动,HClO浓度增大;乙瓶中因HClO具有强氧化性,可将NaHSO3氧化,从而使HClO浓度下降。
答案:B
12.(1)氯气对饮用水消毒的原理是 。
氯气的消毒能力受水的pH的影响,pH小时的消毒能力__pH大时的消毒能力(填“>”或“<”),其原因是 。
(2)通常用氯酸钠(NaClO3)与浓盐酸反应来制取ClO2,同时生成Cl2,写出化学方程
式: 。
市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4。两种成分在溶液中混合便产生ClO2,写出化学方程式: 。
某同学打算通过研究性学习,比较这两种制取ClO2的方法的利与弊。要拟定一个简略的研究方案,你认为应该从哪些方向进行研究?
解析:根据题目信息知氯气消毒的原理是氯气与水作用产生HClO(具有杀菌、消毒作用)。
本材料考查自来水的消毒问题,同时题中设置了研究性学习问题,这也是当前高考改革的方向。比较两种制取方案的利与弊可以从材料进行分析,也可以根据它们的制备方法进行分析等。
答案:(1)Cl2和水反应生成次氯酸:Cl2+H2O===HClO+HCl,HClO起杀菌消毒作用 > pH大时HClO容易转化为ClO-
(2)2NaClO3+4HCl(浓)===Cl2↑+2ClO2↑+2NaCl+2H2O 2NaClO3+Na2C2O4===2ClO2↑+2Na2CO3 原料的包装和运输是否简便易行;pH对消毒能力的影响;制取是否方便;副产物的多少;产物对水质的影响;稳定性;安全性等

11.2009年11月12日,中华网报道:贵州省某少数民族自治县位于山区的一化学试剂厂,发生氯气泄漏事故,泄漏出的氯气迅速向周围的居民区蔓延,所到之处草木枯黄、大片蔬菜被毁。请回答下列问题:
(1)如果你当时在现场,你应该往哪里撤离?(填“山坡上”或“低洼处”)A__;
(2)如果你在该厂实验室准备撤离时,应该准备什么样的简易“防毒面具”避免吸入较多的氯气? ;
(3)如果你当时在距离化工厂较近的居民家中,如何利用家中现成物质来制作简易“防毒面具”? ;
(4)消防官兵赶到现场处理,他们先把泄漏的氯气钢瓶投入一盛有某物质水溶液的水池中,该物质是 ;
(5)对弥漫在空气中没有散去的氯气,消防队员喷洒了一种挥发性化学物质的水溶液进行处理,该化学物质是__。
解析:性质决定处理方案ρ(Cl2)比ρ(空气)大―→山坡上

答案:(1)山坡上 (2)用蘸有稀碳酸钠溶液的湿毛巾捂住口鼻 (3)用蘸有稀碳酸钠溶液、小苏打溶液或肥皂水的湿毛巾捂住口鼻 (4)NaOH (5)氨水
10. 某化学兴趣小组为了探究某些气体的化学性质,设计出如图所示的实验装置。实验时,将A、C中产生的气体都通入B中。
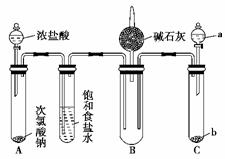
(1)实验前如何检查A部分装置的气密性? 。
(2)碱石灰的作用是 。
(3)如果a、b分别是____,则实验过程中可能发生爆炸,必须禁止。
(4)如果a、b分别是浓磷酸(磷酸是高沸点酸)、NaI,在B中将会看到: 。
(5)如果在B中将会看到白烟生成,写出生成白烟的化学方程式: 。
解析:A中生成Cl2,进入B中的气体肯定有潮湿的Cl2,C中由于a、b不确定,可以生成的气体不确定,但产生的气体在常温下能与Cl2发生反应。
答案:(1)用止水夹夹住A的导气管,关闭分液漏斗旋塞,向分液漏斗中加水,然后打开分液漏斗旋塞,当少许水滴入试管后停止滴水,说明装置不漏气 (2)吸收尾气 (3)稀硫酸(或稀盐酸)、Zn(或Fe) (4)有紫黑色固体生成 (5)3Cl2+8NH3===6NH4Cl+N2
9.某同学用下列装置制备并检验Cl2的性质。
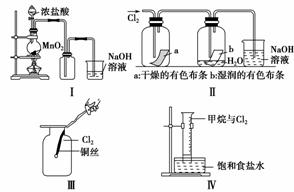
(1)Ⅰ图圆底烧瓶中反应的化学方程式为 。
(2)Ⅱ图中退色的是A__(填“a”或“b”),Ⅱ图烧杯中发生反应的离子方程式是 。
(3)将铜丝换成铁丝,做Ⅲ实验,结果也能点燃,你认为铁丝也能点燃的理由是A__(填选项字母)。
A.Fe与Cu都是金属元素 B.Fe的熔点比Cu高
C.Fe的密度比Cu小 D.Fe的金属性比Cu强
(4)将Ⅳ装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅,量筒内液面上升等。
①油状液滴的成分可能是(写分子式) ____。
②水槽用饱和食盐水而不用水的原因是 。
③饱和食盐水中有少量固体析出,其原因是 。
(5)将硫酸溶液滴入Ⅱ图实验后的烧杯中,至溶液显酸性,结果也有Cl2生成,其原因是(用离子反应方程式表示) 。
解析:(1)(2)(4)都是教材中实验所解决的问题,很容易就能回答。(3)是对两种金属的比较,Cu能发生的反应,则比Cu更活泼的Fe也能够发生反应。(5)此问是本题的一个难点,溶液中有Cl-和ClO-,加酸酸化后,两者应该发生氧化还原反应。
答案:(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (2)b Cl2+2OH-===Cl-+ClO-+H2O (3)D (4)①CH2Cl2、CHCl3、CCl4 ②降低Cl2在水中的溶解度,抑制Cl2和水的反应 ③反应中有HCl生成,使溶液中的Cl-浓度增大,促使NaCl的溶解平衡向生成NaCl固体的方向移动 (5)Cl-+ClO-+2H+===Cl2↑+H2O
8.氯水是含多组分的混和物,其性质在不同的反应中有不同的体现,例如:
用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然退去,试回答下列问题:
(1)实验室保存饱和氯水的方法是 。
(2)产生上述现象的原因可能有两种(简要文字说明)
①是由于 ;
②是由于 。
简述怎样用实验证明红色退去的原因是①或者是②: 。
解析:能使变红的酚酞退色的原因是溶液碱性减弱(中和碱性)或过量氯水中的HClO将变红的酚酞漂白,若要设计实验证明退色的可能原因,最简便的方法就是在退色后溶液中再滴加NaOH溶液,若不再出现红色,说明是HClO漂白作用的结果;若再出现红色,说明是氯水与NaOH反应,碱性减弱的原因。
答案:(1)在棕色试剂瓶中密封保存并置于阴凉处
(2)①氯水与NaOH反应生成两种盐,碱性减弱 ②氯水过量后HClO的漂白性将溶液变成无色 向无色溶液中再滴加NaOH溶液,若不再出现红色,应为原因②,若再出现红色,应为原因①
7. ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
解析:NaClO3和Na2SO3溶液在酸性条件下的反应是一个氧化还原反应,要确定NaClO3和Na2SO3的物质的量之比,只要将方程式配平即可。根据方程式:2NaClO3+Na2SO3+H2SO4===2ClO2↑+2Na2SO4+H2O知,n(NaClO3)∶n(Na2SO3)=2∶1。
答案:B
6.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是( )
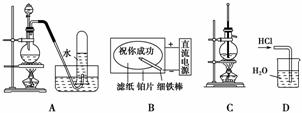
A.二氧化锰与浓盐酸反应制干燥氯气
B.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用外加保护膜的细铁棒做笔在滤纸上写字显红色字迹
C.石油的分馏
D.用水吸收氯化氢气体
解析:用排水法收集Cl2,得不到干燥氯气,故A选项不正确;细铁棒接电源负极,作阴极产生H2,阴极附近OH-的浓度增大,遇酚酞变红色,故B选项正确;石油分馏温度计的水银球应在支管口附近,故C选项错误;HCl极易溶于水,用此装置会引起倒吸,不安全,故D选项错误。
答案:B
5.某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
A. 氧化性:HClO>I2>SO
B.蓝色消失的原因是Na2SO3溶液具有漂白性
C.淀粉KI溶液变蓝是因为I-被HClO氧化为I2,I2遇淀粉变蓝
D.若将Na2SO3溶液加入氯水中,氯水退色
解析:SO具有强还原性,可被HClO和I2氧化。第二步溶液蓝色消失是SO还原I2的结果。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com