
题目列表(包括答案和解析)
4.(2009·潍坊统考)取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A.②⑤ B.①②③ C.①④⑤ D.④⑤
解析:根据钠在氧气中燃烧的现象可选C。
答案:C
3. 在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是( )
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
解析:
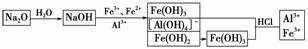
微粒数目几乎不变的是Al3+。
答案:B
2.某研究性学习小组设计如下实验方案测定氧化钠样品中过氧化钠的含量。实验步聚:①取一定质量的样品放入烧杯中,加入足量稀盐酸,搅拌使之充分反应;②将反应后的溶液倒入蒸发皿中蒸发至恒重,冷却、称重。若在蒸发过程中,局部温度过高,造成液滴飞溅,则实验结果会( )
A.偏低 B.偏高 C.无影响 D.无法判断
解析:设取a g样品,得到产物为b g,那么有
①n(Na2O)·62 g/mol+n(Na2O2)·78 g/mol=a g
②2[n(Na2O)+n(Na2O2)]·58.5 g/mol=b g
由①②可得出n(Na2O2)=,可见b越小,n(Na2O2)越大。
答案:B
1.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的11/12(同温同压)所得混合气体中N2、O2、CO2的物质的量之比为(反应前后状态完全相同)( )
A.6∶7∶3 B.3∶4∶3 C.4∶5∶2 D.1∶2∶1
解析:假设原混合气体中N2、O2、CO2分别为4体积(总体积为12),反应的CO2为2体积,生成O2为1体积,反应后的气体中,N2为4体积,O2为5体积、CO2为2体积(总体积为11体积)。显然选项C正确。
答案:C
10. (2009·宁夏理综,27)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
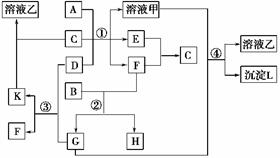
(1)A、B、C、D代表的物质分别为__、__、__、__(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是____;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是__、__(填化学式);
(4)反应③产物中K的化学式为 ;
(5)反应④的离子方程式为 。
解析:(1)由C是常见无色无味液体,推知为H2O;D是淡黄色固体化合物,推知D为Na2O2,C、D反应后生成NaOH,并且又能和常见金属单质A反应,可知A为Al;由B为黑色非金属单质,猜测为碳。
(2)分步书写,减少错误。先写出Na2O2与H2O的反应,生成的NaOH再与Al发生反应。
(3)根据C和O2反应的物质的量,两者比值为4∶4时产物为CO2,比值为4∶2时,产物为CO,现在比值为4∶3,所以产物为CO2和CO的混合物。
(4)反应③Na2O2和CO2反应生成Na2CO3和O2。
(5)反应④溶液甲的成分为NaOH和Na[Al(OH)4],通入CO2后,CO2可以和Na[Al(OH)4]溶液反应生成Al(OH)3沉淀,同时CO2又和NaOH反应生成Na2CO3,两者相加,即得总方程式,然后再拆为离子方程式。
答案:(1)Al C H2O Na2O2
(2)2Na2O2+2H2O===4NaOH+O2↑ 2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(3)CO2 CO (4)Na2CO3(5)CO2+2[Al(OH)4]-+OH-+H2O===CO+Al(OH)3↓+H2O
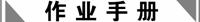
9. 某研究学习小组的同学为了探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验。通入过量的SO2气体后,用带余烬的木条检验从C导出的气体,木条复燃。实验前称得Na2O2固体的质量为m1 g,充分反应后称得生成物固体质量为m2 g。回答下列问题:
(1)依据题中所描述的现象,推测装置B中发生了怎样的反应,写出反应的化学方程式: 。
(2)设计一种实验方案,验证你对上述推测的结论是正确的。
。
(3)装置C的作用是 。
(4)根据反应前后固体的质量,通过计算判断m2的取值范围?(用含m1的关系式表示)
解析:(1)根据实验现象可知,SO2在没有H2O的存在下与Na2O2反应生成Na2SO3和O2,O2再将Na2SO3氧化为Na2SO4。
(2)检验有Na2SO3和Na2SO4生成即可。
(3)SO2属于大气污染物且不能有水蒸气进入装置B中,防止产生干扰。
(4)用极端假设法求解。若生成物只有Na2SO3时,有m2=,若生成物只有Na2SO4时,有m2=,故m2的取值范围为<m2<。
答案:(1)2SO2+2Na2O2===2Na2SO3+O2,2Na2SO3+O2===2Na2SO4
(2)实验方案:
取少量反应后的白色固体,加入过量的稀盐酸,若产生能使品红溶液退色的气体,则证明反应物中有Na2SO3产生。在反应后的溶液中加入BaCl2溶液,若生成白色沉淀,则证明反应中有Na2SO4生成,说明B装置中发生了上述两个反应
(3)吸收过量的SO2防止造成空气污染,防止空气中的水蒸气进入B装置
(4)<m2<。
8.金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示:

(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中加入一小块金属钠。下列现象描述正确的是( )
A. 钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2请补充并完成甲实验中从试剂中取出钠到向水槽中投入钠的有关操作;用镊子从试剂中取出一块钠→ 用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功。正确的关键操作是 。
(4)用装满水的矿泉水瓶按图丙方法进行实验,用手挤压矿泉水瓶并塞紧带有钠的塞子,排出水的体积共为16.8 mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均处于标准状况,则所用的钠的质量为 g。
解析:(1)将钠加入到Ca(HCO3)2溶液中,钠先要与水反应,生成氢氧化钠。氢氧化钠再与Ca(HCO3)2反应,生成碳酸钙沉淀。(2)用镊子从试剂瓶中取出一小块钠以后的操作是:用滤纸吸干表面的煤油,在玻璃片上用小刀切下绿豆大小的钠粒,并将多余的钠放回试剂瓶中。(3)不能直接将钠浸入水中来收集气体,因为反应过于剧烈,应用铝箔把钠包好后再扎上一些小孔,再用镊子夹住。(4)由排出水的体积为16.8mL,可知n(H2)=0.000 75 mol,n(Na)=0.001 5 mol,m(Na)=0.034 5 g。
答案:(1)ABD (2)用滤纸吸干表面的煤油,在玻璃片上用小刀切下绿豆大小的钠粒,并将多余的钠放回试剂瓶中 (3)用铝箔把钠包好后再扎上一些小孔,再用镊子夹住 (4)0.034 5
7.教材必修一课后习题中关于过氧化钠的性质探究实验,某同学在学习后做了如下改进并进行实验:经过改进,用脱脂棉包住约0.2 g 过氧化钠粉末,置于石棉网上,往脱脂棉上滴加几滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a.有氧气生成;b. 。
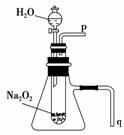
(2)某学校研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验操作方法及现象是 。
②用以验证结论b的实验操作方法及现象是 。
(3)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
解析:(1)由脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴加几滴水,可观察到脱脂棉剧烈燃烧起来,可知Na2O2和H2O反应是放热反应。(2)由题图装置可知,p口处放出氧气,因而验证氧气的生成,应在导管口p处放一带火星的木条,发现木条复燃。如果本反应是放热反应,则试管的温度必然升高,使锥形瓶内的空气温度升高,则空气被排出。所以应将导管q插入水槽中,再打开分液漏斗的开关,发现q处有气泡放出,即可证明该反应为放热反应。(3)过氧化氢在二氧化锰作用下分解放出氧气,所以加入二氧化锰来检验是否有氧气生成即可。
答案:(1)反应放出热量 (2)①加水后,将带火星的木条置于导管口P处,发现木条复燃 ②将导管q插入水槽中,再打开分液漏斗的开关,发现q处有气泡放出 (3)MnO2 放出使带火星的木条复燃的气体(其他合理答案也可)
6. (原创)某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气 推测,你认为不合理的是( )
A. 黑色固体是碳
B.钠在燃烧时只发生了一个反应
C.钠在金属活动顺序表中排在镁的前面,所以钠能与二氧化碳反应
D.钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
解析:该题首先要从钠的保存、空气的组成等多方面分析黑色固体的来源,钠及其化合物没有黑色的,所以黑色物质所含元素只能来自煤油或空气,所以只有选项B不合理。
答案:B
5. (2010·模拟精选,北京东城模拟)200℃时,11.6 g由CO2和H2O组成的混合气体与足
量Na2O2充分反应后,固体质量增加3.6 g,则原混合气体的平均摩尔质量为(g·mol-1)
( )
A.5.8 B.11.6 C.23.2 D.46.4
解析:本题属于有关混合物的计算题;设气体混合物中CO2的物质的量为x mol,
H2O的物质的量为y mol。
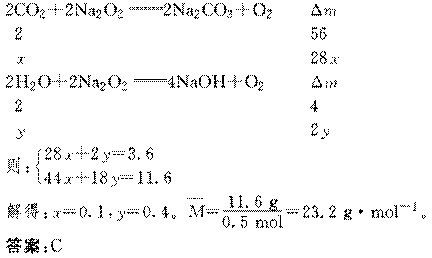
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com