
题目列表(包括答案和解析)
0.12 L×4 mol·L-1-)=0.21 mol
据Fe守恒,被H2还原时得出铁的物质的量为:n(Fe)=n[Fe(NO3)2]=0.21 mol。
答案:A
4.(2010·启东调研)向一定量Fe、FeO和Fe2O3的混合物中,加入120 mL 4 mol·L-1的
稀硝酸,恰好使混合物完全溶解,放出1.344 L(标准状况)气体,往所得溶液中加入
KSCN溶液,无红色出现,若用足量的H2在加热条件下还原相同质量的混合物,
能得到铁的物质的量为( )
A.0.21 mol B.0.14 mol C.0.16 mol D.0.24 mol
解析:据题意,反应后溶液中只有Fe(NO3)2,据氮元素守恒有:n[Fe(NO3)2]=×
0.03 mol·L-1∶0.04 mol·L-1=3∶4。
答案:D
3.将Cu片放入0.1 mol·L-1 FeCl3溶液中,反应一段时间后取出Cu片,溶液中
c(Fe3+)∶c(Fe2+)=2∶3,则溶液中Cu2+和Fe3+的物质的量之比为(不考虑溶液体
积变化)( )
A.3∶2 B.3∶5 C.4∶3 D.3∶4
解析:由铁守恒得,反应后生成c(Fe2+)=×0.1 mol·L-1=0.06 mol·L-1,剩余
c(Fe3+)=×0.1 mol·L-1=0.04 mol·L-1,由方程式知2Fe3++Cu===2Fe2++Cu2+,
故n(Cu2+)∶n(Fe3+)=c(Cu2+)∶c(Fe3+)=0.06 mol·L-1/2∶0.04 mol·L-1=
2.向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol
铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论
错误的是( )
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶2
D.1 mol Fe可还原2 mol Fe3+
解析:根据金属活动顺序表,银的还原性较差,一旦失去电子变成银离子其氧化性
较强。铁粉先跟银离子反应,然后再与三价铁离子反应,由反应方程式或电子守恒
得,银离子、三价铁离子完全反应后铁粉没有剩余,B、C选项正确。一个铁失两个
电子,一个三价铁离子得一个电子,所以1 mol铁可还原2 mol三价铁离子。
答案:A
1.将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是( )
A.硫酸 B.氯水 C.硝酸锌 D.溴水
解析:Fe与非氧化性酸作用生成Fe2+,当Fe2+一旦遇强氧化剂便容易转变为Fe3+。
对于选项A,硫酸符合要求,因为稀硫酸属非氧化性酸;对于选项B,氯水组成中
有Cl2、HClO等强氧化剂,最终铁元素被氧化为Fe3+;对于选项C,硝酸锌加入到
Fe2+溶液中,相当于Fe2++H++NO,Fe2+立即被酸化的NO氧化生成Fe3+;对于
选项D,溴水可氧化Fe2+,生成Fe3+。
答案:A
18.为了探究乙醇和金属钠反应的原理,做了如下四个实验
实验一:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体。
实验二:设法检验实验一收集到的气体。
实验三:向试管中加入3 mL水,并加入一小块金属钠,观察现象。
实验四:向试管中加入3 mL乙醚,并加入一小块金属钠,观察现象。
回答以下问题:
(1)简述实验二中检验气体的实验方法及作出判断的依据: 。
(2)从结构上分析,该实验选取水和乙醚做参照物的原因是 。
(3)实验三的目的是欲证明 ;实验四的目的是欲证明 ;根据实验三和实验四的结果,可以证明乙醇和金属钠反应的化学方程式为 。
解析:本题中实验一与实验二是探究乙醇与钠反应,生成的气体是氢气,利用爆鸣实验可证明生成的气体是H2;若用定量实验法,便可推出乙醇分子中的6个H原子只有一个H原子参与反应;实验三与实验四是对比实验,从而达到实验探究目的。
答案:(1)将收集到的气体点燃,若能燃烧或发出爆鸣声则证明该气体是氢气。
(2)乙醇分子中含有乙基和羟基而水分子中含羟基,乙醚分子中含有乙基。
(3)羟基氢可和钠发生置换反应 乙基上的氢不能和钠发生置换反应 2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
17.为证明有关物质的性质,某学生设计了如图装置,当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛慢慢熄灭,关闭C打开E时,则看到G中蜡烛燃烧得更亮。
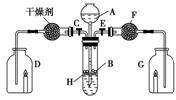
(1)请写出这名学生设计的实验中有关仪器中盛放的常见物质的名称:AA__,BA__,FA__。
(2)仪器A的名称为 。
(3)用化学方程式表示上述实验中发生的反应(至少写两个)。
解析:由D中蜡烛慢慢熄灭,推测产生的气体可能是CO2;G中蜡烛燃烧得更亮,说明进入G的气体是O2,那么进入F的气体是CO2,从F逸出的气体是O2,推断F中盛有Na2O2。
答案:(1)稀盐酸 碳酸钙 过氧化钠 (2)长颈漏斗
(3)①2HCl+CaCO3===CO2↑+CaCl2+H2O ②2CO2+2Na2O2===2Na2CO3+O2
16. 在低压低温条件下,将Na2O粉末放入盛有CO2和水蒸气[n(CO2)<n(H2O)]的密闭容器中充分反应。
(1)若Na2O粉末的质量为6.2 g,反应完全后容器内仍有较多的CO2剩余,则在反应后容器内的固体物质中一定含有A__,该固体的质量为A__;若反应完全后容器内只有H2O蒸气剩余,则容器中固体的质量m的取值范围是A__。
(2)若Na2O的质量为a g,混合气体的物质的量为b mol,反应完全后容器内CO2有剩余,则在b mol混合气体中CO2的物质的量x的取值范围是A__。
(3)若Na2O的质量仍为a g,混合气体的物质的量仍为b mol,反应后容器内气体无剩余,则反应后容器内固体物质质量的取值范围是A__。
解析:(1)容器中仍有CO2剩余时固体物质是NaHCO3,其质量为16.8 g。若反应后容器中只有H2O(g)剩余。在极值情况下固体的成分可能是NaOH或NaHCO3,
所以8g<m<16.8 g。
(2)若反应后容器中有CO2剩余,则发生的反应为:
Na2O + 2CO2+H2O===2NaHCO3
1 mol 2 mol
mol n(CO2)
n(CO2)= mol,由于CO2有剩余,所以x> mol
而n(CO2)<n(H2O),所以x< mol。
(3)由于气体无剩余,所以气体的质量就是固体增重的质量。当b mol混合气体几乎全部是H2O(g)时质量最小为18b g。当CO2与H2O(g)几乎等摩尔时质量最大为31b g。所以(a+18b)<m<(a+31b)。
答案:(1)NaHCO3 16.8 g 8 g<m<16.8 g (2) mol<x< mol
(3)(a+18b)g<m<(a+31b) g
15.在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol/L(忽略溶液中离子的水解和溶解的氢气的量)。
(1)该实验中涉及到的化学反应有:
①
②
③
(2)钠块中钠元素的质量分数是 。
解析:(1)①2Na+2H2O===2NaOH+H2↑
②Na2O+H2O===2NaOH
③2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(2)n(Al)==0.010 mol
根据反应③可得由铝消耗NaOH的物质的量为n(NaOH)=0.010 mol
生成的氢气的物质的量为n(H2)=0.015 mol
那么由金属钠生成的氢气的物质的量为n(H2)=-0.015 mol=0.035 mol
根据反应①可得金属钠的物质的量为n(Na)=2×0.035 mol=0.070 mol
又因为反应后溶液中的NaOH的物质的量为n(NaOH)=2.0 L×0.050 mol/L=0.10 mol
所以溶液中Na+的总物质的量即原金属钠的总物质的量为n(Na+)=0.10 mol+0.010 mol=0.11 mol,n(Na2O)==0.020 mol
该钠块中钠元素的质量分数为:×100%≈89%。
答案:(1)①2Na+2H2O===2NaOH+H2↑ ②2Na2O+H2O===2NaOH
③2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑ (2)89%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com