
题目列表(包括答案和解析)
1.误食亚硝酸盐会使人体中毒,因为亚硝酸盐会使人体血红蛋白中的Fe2+转化为Fe3+,使血红蛋白丧失与O2结合的能力。服用维生素C可以缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.氧化性 B.还原性 C.酸性 D.碱性
解析:因亚硝酸盐会使人体血红蛋白中Fe2+转化为Fe3+,说明亚硝酸盐有氧化性,
维生素C可以缓解亚硝酸盐中毒,故维生素C具有还原性。
答案:B
13.铁做为重要的金属元素与人类生产生活密切相关,某课外活动小组在学习了氧化剂和还原剂后,要利用实验验证铁及其化合物的性质。
请你帮助他们完成以下实验报告:
(1)实验目的:探究铁及其化合物的氧化性和还原性。
(2)试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
(3)仪器:胶头滴管,________(你认为本实验必不可少的一种玻璃仪器)。
(4)实验记录(划斜线部分不必填写)
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为黄色 |
|
Fe2+具有还原性 |
|
② |
在FeCl2溶液中加入锌片 |
- |
Zn+Fe2+===Zn2++Fe |
|
|
③ |
在FeCl3溶液中加入足量铁粉 |
|
Fe+2Fe3+===3Fe2+ |
Fe3+具有氧化性 |
|
④ |
|
- |
- |
Fe3+具有氧化性 |
(5)实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
①根据以上结论判断,下列物质中既有氧化性,又有还原性的有________(填序号)。
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
②亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶
液时应该________防止亚铁盐被氧化。
解析:根据探究实验目的和提供的试剂分析,本实验只需要试管和胶头滴管就可以完
成。再结合实验记录中部分内容,就可以判断利用铁粉与FeCl3反应,探究出Fe的还
原性,Fe3+的氧化性;利用提供的氯水、FeCl2(aq),推断Fe2+具有还原性,利用FeCl2(aq)
和锌片推断Fe2+有氧化性。最后推出具有中间价态的Fe2+既具有氧化性又具有还原
性,从而判断A、E、F也符合以上规律。
答案:(3)试管 (4)①Cl2+2Fe2+===2Cl-+2Fe3+ ②Fe2+具有氧化性 ③铁粉逐渐溶
解,溶液由黄色变为浅绿色 ④在FeCl3溶液中加入铜片 (5)①AEF ②在亚铁盐溶
液中加入少量铁粉
12.将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。试判断下列情况下,溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有
_____________________________________________________________________;
(2)若氯化铜有剩余,则容器中可能有
___________________________________________________________________;
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有____________,可能有
__________。
解析:本题属于物质共存问题。解答时应首先弄清物质间可能发生的反应,凡相互
间能发生反应的物质就不可能大量共存。本题涉及的反应有:
①Fe+2FeCl3===3FeCl2
②Fe+CuCl2===Cu+FeCl2
③Cu+2FeCl3===2FeCl2+CuCl2
(1)若铁粉有剩余,则容器中不可能有Fe3+、Cu2+,因为它们能发生上述①②反应。
(2)若CuCl2有剩余,则容器中不可能有Fe,可能有Fe2+、Fe3+或Fe2+、Cu。
(3)若FeCl3和CuCl2均有剩余,则容器中不可能有Fe、Cu,可能有Fe2+。
答案:(1)Fe3+、Cu2+ (2)Fe2+、Fe3+或Fe2+、Cu
(3)Fe、Cu Fe2+
11.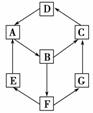 (原创)在一次化学兴趣小组活动中,一小组利用物质间互变,设计成一平面“魔方”,如图所示:
(原创)在一次化学兴趣小组活动中,一小组利用物质间互变,设计成一平面“魔方”,如图所示:
已知:①A、B、C、D、G含有同一种元素。
②有下列表格:
平面“魔方”
|
物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉
淀;在水溶液中B也能将一种气体氧化物氧化为F,F是含有三种元素的化合物,
与A反应生成E和G。
根据以上信息填空:
(1)写出D的化学式________;G生成C的过程中所出现的现象为___________
_____________________________________________________________。
(2)写出下列反应的化学方程式:E→A________;A→B________。
(3)B→F的离子方程式为__________________________________________。
解析:本题切入点是物质的颜色。依题意,E为氢气,B中含氯离子,所以B为氯
化铁,A为铁。D为氧化铁,F与铁反应生成氢气和G,F是一种气体氧化物在水
溶液中被氯化铁氧化而成,说明F为硫酸,G为硫酸亚铁,则C为Fe(OH)3。
答案:(1)Fe2O3 先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色 (2)4H2+
Fe3O43Fe+4H2O 2Fe+3Cl22FeCl3 (3)2Fe3++SO2+2H2O===2Fe2+
+SO+4H+
10.类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量
时,产物是Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,
当Cl2足量时生成FeCl3,当铁粉过量时产物是FeCl2。为验证该观点是否正确,该
同学将一根细的纯铁丝分别在足量和少量的Cl2中点燃,取其表面生成物并分别编
号为A、B,然后通过实验确定其成分。探究过程如下:
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:分别取A、B的溶液进行以下实验,但实验现象相同。请填写下
表中的相应空格。
|
实验方法 |
实验现象 |
结 论 |
|
分别向A、B溶液中加KSCN溶液 |
|
固体物质中有FeCl3 |
|
分别向KMnO4溶液中加适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含________ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:
________________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显
错误的是_______________________________________________________。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
解析:(2)由分别向A、B溶液中加入KSCN溶液后,得出的结论为固体物质中有三
氯化铁,可知实验现象为A、B溶液遇KSCN溶液均显红色;由分别向高锰酸钾溶
液中加入A、B,高锰酸钾有强氧化性,如果有Fe2+存在,能使KMnO4溶液褪色,
但实验现象是高锰酸钾溶液颜色无明显变化,所以该固体中不含有FeCl2。(3)由上述
实验结论可知,铁在氯气中燃烧,无论铁粉过量还是少量均得到三氯化铁。(4)向FeCl3
溶液中加入铁粉,将三价铁还原为二价铁,颜色变浅;加热FeCl3溶液时促进FeCl3
水解:FeCl3+3H2OFe(OH)3↓+3HCl,蒸干并灼烧,最后得到的固体是三氧化
二铁,所以答案为BD。
答案:(2)溶液均变红色 FeCl2 (3)2Fe+3Cl22FeCl3 (4)BD
9.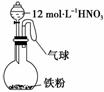 如右图所示,向一定量的铁粉中加入一定体积12
mol/L的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是( )
如右图所示,向一定量的铁粉中加入一定体积12
mol/L的硝酸,加热充分反应后,下列微粒在体系中一定大量存在的是( )
①NO ②Fe3+ ③H+ ④NO ⑤NO2
A.只有① B.①⑤
C.②④⑤ D.①②③⑤
解析:题给12 mol·L-1的硝酸是浓硝酸,若铁少量则生成Fe3+,若铁过量则生成
Fe2+,故在该体系中一定存在NO2和NO。
答案:B
8.将下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段
时间;③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中。
A.②③①④ B.③②①④ C.③①②④ D.①②③④
解析:Na2O2呈淡黄色,Fe(OH)3呈红褐色、[Fe(SCN)]2+呈红色、CuSO4溶液呈蓝色。
答案:B
7.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易锈蚀。 ②在人体的血红蛋白中含有铁元素。
③铁位于周期表中的第四周期第ⅧB族。 ④铁能在氧气中剧烈燃烧,但不能在
水蒸气中燃烧。 ⑤铁与硝酸反应的产物仅是Fe(NO3)3。 ⑥不能通过化合反应
生成FeCl2和Fe(OH)3。
A.①③ B.②④ C.②⑤ D.④⑥
解析:①中纯铁不易被锈蚀;③中Fe位于第Ⅷ族,而不是ⅧB族;⑤中当铁过量
时可生成Fe(NO3)2;⑥可以通过化合反应生成FeCl2和Fe(OH)3,2FeCl3+
Fe===3FeCl2,4Fe(OH)2+O2+2H2O===4Fe(OH)3。
答案:B
6.鉴定某一FeCl2溶液中阳离子只有亚铁离子,最好采用( )
A.加入NaOH溶液
B.加入KSCN溶液
C.先通入氯气,再加入KSCN溶液
D.先加足量铁粉,再加入KSCN溶液
解析:题目本意是证明溶液中,无三价铁离子,而不需要再证明有无亚铁离子,因
此最好是加入KSCN溶液。如果还要证明有无亚铁离子,则应该先加KSCN溶液,
再加入新制氯水或通入氯气。
答案:B
5.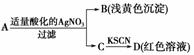 某同学设计下列方法对A盐的水解液进行鉴定:
某同学设计下列方法对A盐的水解液进行鉴定:
由此得出的结论中,不正确的是( )
A.D溶液中存在Fe(SCN)3
B.滤液中有Fe3+
C.B为AgBr
D.A一定为无氧酸盐FeBr2
解析:根据B、D现象可确定A是由Fe3+和Br-或由Fe2+和Br-组成的盐。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com