
题目列表(包括答案和解析)
11.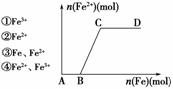 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如右图所示。请将正确答案的序号填在相应的横线上。
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如右图所示。请将正确答案的序号填在相应的横线上。
(1)AB段铁元素以________形式存在。
(2)BC段铁元素以________形式存在。
(3)CD段铁元素以________形式存在。
解析:向稀HNO3中加入铁粉,开始时稀HNO3过量应生成Fe3+,随加入铁粉量的
增加,发生反应2Fe3++Fe===3Fe2+,最后全部转化为Fe2+。
答案:(1)① (2)④ (3)③
10.把22.4 g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是( )
A.反应后生成的盐只为Fe(NO3)3
B.反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
解析:由于铁的物质的量为=0.4 mol,所以在反应的过程中它失去的电
子数应介于0.8 mol(此时只产生Fe2+)和1.2 mol(此时只产生Fe3+)之间,又产生0.3
mol NO2和0.2 mol NO,即反应过程中硝酸得到的电子数为0.3 mol×(5-4)+0.2
mol×(5-2)=0.9 mol,所以对应的产物既有 Fe(NO3)3又有Fe(NO3)2,设前者的
物质的量为x,后者的物质的量为y,则由铁守恒可得x+y=0.4,由得失电子守恒
得3x+2y=0.9 mol,解得x=0.1 mol,y=0.3 mol。
答案:C
9.(2010·模拟精选,苏州模拟)在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是( )
A.最后得到的溶液中含有Fe3+ B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+ D.残余固体一定全部是铜
解析:由题可知b<c说明一定有Cu生成,而Fe粉可能不足,也可能过量,即溶液
中一定有Fe2+,一定无Fe3+,可能有Cu2+,残余固体可能为Cu,也可能为Cu、Fe
混合物。
答案:B
8.(2010·济宁期末)下列反应的离子方程式正确的是( )
A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-===Fe(OH)3↓
B.硫化钠溶液与氯化铁溶液反应: 2Fe3++3S2-===Fe2S3
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++NO===4Fe2++3H2O+NH
D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+===FeS↓+2H+
解析:A项中缺少SO与Ba2+起反应的离子方程式。B项中Fe3+与S2-发生氧化还
原反应 ,离子方程式为2Fe3++S2-===2Fe2++S↓。C项中无气体放出,说明NO
被还原为NH,离子方程式符合书写要求。D项中由于盐酸比H2S酸性强,且HCl
能溶解FeS,故D项反应不能发生。
答案:C
7.(2010·深圳期末)有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
解析:将过量NaOH溶液分别加入上述几种溶液,无明显现象的是NaCl,生成白色
沉淀且迅速变为灰绿色最后变为红褐色的是FeCl2,生成红褐色沉淀的是FeCl3,生
成白色沉淀不溶解的是MgCl2,生成白色沉淀又溶解的是AlCl3,而氨水虽然能区分
出NaCl、FeCl2、FeCl3,但不能将MgCl2与AlCl3区分开。
答案:B
6.将几滴KSCN(SCN-是“类卤素离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成红色,将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向
另一份中通入SO2,红色也褪去。下列说法不正确的是( )
A.①红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B.②红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
解析:由于SCN-是类卤素离子,与卤素离子性质相似,可以被KMnO4氧化为(SCN)2,
而使红色消失。Fe3+具有氧化性,可被SO2还原为Fe2+,也可使红色消失。综上分
析可知C项错误。
答案:C
5.向某晶体的水溶液中加入含Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现红色,那么由此得出的下列结论,错误的是( )
A.该晶体中一定含有SCN- B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+ D.Fe2+与SCN-不能形成红色的化合物
解析:混合液呈现红色,说明Fe3+与SCN-发生了络合反应,由此推知Br2能将
Fe2+氧化为Fe3+,且原晶体中含有SCN-;开始加入Fe2+,溶液颜色无明显变化,
说明Fe2+不能与SCN-结合成红色物质。
答案:B
4.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关,下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
解析:Cu与HNO3反应时,Cu与浓HNO3反应产生NO2,而与稀HNO3反应产生
NO,产物不同;Zn与稀H2SO4反应产生H2,而与浓H2SO4反应产生SO2。Cu与
FeCl3溶液反应只生成FeCl2和CuCl2,Fe与HCl溶液反应只生成FeCl2和H2,均
与浓度和反应温度无关。
答案:A
3.下列各对试剂中,用来制备硫酸亚铁最合适的是( )
A.Fe(NO3)2和稀硫酸 B.Fe(OH)2和稀硫酸
C.Fe3O4和稀硫酸 D.Fe和稀硫酸
解析:事实上,工业上就是用Fe和稀硫酸反应制取硫酸亚铁;A项相当于Fe2+和
HNO3发生氧化还原反应,只能得到Fe3+而得不到FeSO4;B项不易得到Fe(OH)2;
C项生成的物质不纯。
答案:D
2.下列物质可由相应的单质直接化合而成的是( )
①FeS ②CuS ③FeCl2 ④Al2S3 ⑤Fe3O4 ⑥Fe2O3
A.①③⑤ B.②③④ C.①④⑤ D.①②③④⑤
解析:Fe与Cl2化合生成FeCl3而不是FeCl2,因此选项中有(3)即错误,所以选C。
经验证,选项C中的所有物质均可由相应的单质直接化合而成。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com