
题目列表(包括答案和解析)
2. 通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是( )
解析:扇子扇煤炉火的目的是增加反应物氧气的浓度,加快煤燃烧的速率。
答案:C
1.可逆反应A(g)+2B(g) 2C(g) ΔH>0速率图像如图所示。导致t′时刻的速率图线变 化的原因可能是( )
2C(g) ΔH>0速率图像如图所示。导致t′时刻的速率图线变 化的原因可能是( )
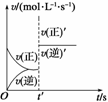
A.增大了A的浓度 B.使用了催化剂
C.增大了压强 D.升高了温度
解析:t′时刻v正′与v逆′均等倍数增大,结合可逆反应的特点分析只有B项符合题意。
答案:B
12.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5
min后,测得D的浓度为0.5
mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1
mol/(L·min)。求:
xC(g)+2D(g),经5
min后,测得D的浓度为0.5
mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1
mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量;
(2)B的平均反应速率;
(3)x值是多少?
解析:设A、B起始时的物质的量均为a,则:
3A(g) + B(g)xC(g) + 2D(g)
起始 a a 0 0
5 min末 a-1.5 a-0.5 0.1×5×2 0.5×2
由于(a-1.5)∶(a-0.5)=3∶5,得a=3
5 min末,c(A)==0.75 mol/L
v(B)==0.05 mol/(L·min)
x∶1=v(C)∶v(B)=0.1 mol/(L·min)∶0.05 mol/(L·min),得x=2
答案:(1)0.75 mol/L n(A)=n(B)=3 mol
(2)0.05 mol/(L·min) (3)2
11. (2009·安徽理综,28)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好
pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该
方法降解有机污染物pCP,探究有关因素对该降解反应速率的影响。
实验设计 控制pCP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
|
298 |
10 |
6.0 |
0.30 |
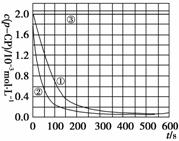
数据处理 实验测得pCP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50-150 s内的反应速率:
v(pCP)=________mol·L-1·s-1。
解释与结论
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:________________________________________________________________________。
(4)实验③得出的结论是:pH等于10时,_______________________________。
思考与交流
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
解析:(1)由题意可知实验①是参照实验,所以与实验①相比,实验②和③只能改变一个条件,这样才能起到对比实验的目的,则实验②是探究温度对反应速率的影响,则T=313 K,pH=3,c(H2O2)=6.0 mol·L-1,c(Fe2+)=0.30 mol·L-1,实验③是探究pH的大小对反应速率的影响;
(2)实验①曲线中,50-150 s内。
Δc(pCP)=1.2×10-3 mol·L-1-0.4×10-3 mol·L-1=0.8×10-3 mol·L-1,
所以V(pCP)==8.0×10-6 mol·L-1·s-1。
(3)在降解反应中,H2O2新产生的自由基起氧化作用,温度过高,H2O2因热稳定性差而分解,导致降解反应速率下降。
(4)由双曲线③可知,pH=10时,c(pCP)基本不变,反应趋于停止。
(5)由(4)得到启示:在pH=10溶液中,反应速率趋于零,可将所取样加入NaOH溶液中(使pH=10)反应停止。
答案:(1)
|
实验 编号 |
实验目的 |
T/K |
pH |
c/10-3 mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
|
|
|
|
|
|
② |
|
313 |
3 |
6.0 |
0.30 |
|
③ |
探究溶液的pH对降解反应速率的影响 |
|
|
|
|
(2)8.0×10-6 (3)过氧化氢在温度过高时迅速分解 (4)反应速率趋向于零(或该降解反应趋于停止) (5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将所取样品骤冷等其他合理答案均可)
10.在下列事实中,什么因素影响了化学反应的速率?
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸__________;
(2)黄铁矿煅烧时要粉碎成细小的矿粒__________;
(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2________;
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体________________;
(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢______;
(6)同样大小的石灰石分别在0.1 mol/L的盐酸和1 mol/L的盐酸中反应速率不同__________;
(7)夏天的食品易变霉,冬天就不易发生该现象______。
解析:影响化学反应速率的因素除了浓度、温度、压强、催化剂以外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等,也会对化学反应速率产生影响。
答案:(1)光 (2)反应物的接触面积 (3)在溶液中,水作溶剂,增大了接触面积 (4)催化剂 (5)反应物本身的性质 (6)反应物的浓度 (7)反应温度
9.在相同条件下进行Mg与HCl、CH3COOH反应的对照实验,相关数据如下:
|
|
Mg的质量 |
酸 量 |
开始时反应速率 |
产生H2总量 |
|
Ⅰ |
0.24 g |
HCl
0.2 mol/L 100 mL |
v1 |
n1 |
|
Ⅱ |
0.24 g |
CH3COOH
0.2 mol/L 100 mL |
v2 |
n2 |
(1)试比较有关量的大小:v1____v2,n1____n2(填“>”、“=”或“<”)
(2)现欲改变条件,使实验Ⅰ中v1降低,但不改变n1的值,试写出两种可行的方法。
方法Ⅰ_____________________________________________。
方法Ⅱ_____________________________________________。
解析:(1)n(Mg)==0.01 mol,n(HCl)=n(CH3COOH)=0.2 mol/L×0.1 L=0.02 mol,因此Mg与HCl、CH3COOH分别反应时,均能恰好完全反应,生成H2总量相同,n1=n2;反应开始时,HCl中c(H+)大于CH3COOH中c(H+),由于c(H+)越大,反应速率越快,所以反应开始时,v1>v2。
(2)改变条件使实验Ⅰ中v1降低,n1不变,需满足c(H+)降低,n(H+)保持不变,因此可采取向HCl中加水稀释或降低温度,或加入CH3COONa固体等方法。
答案:(1)> =(2)加少量水 降温或加少量CH3COONa固体
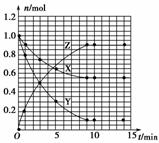
8. (2009·全国Ⅱ,27)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,画出X、Y、Z的物质的量(n)随时间(t)变化的曲线。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
(2)体系中发生反应的化学方程式是_________________________________;
(3)列式计算该反应在0-3 min时间内产物Z的平均反应速率:________________;
(4)该反应达到平衡时反应物X的转化率α等于________;
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z的物质的量随时间变化的曲线①、②、③(如图所示),
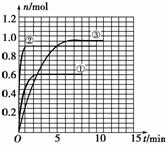
则曲线①、②、③所对应的实验条件改变分别是:
①______________,②______________,③______________。
答案:(1)
(2)X(g)+2Y(g) 2Z(g)
2Z(g)
(3)=0.083 mol·L-1·min-1
(4)45% (5)①升高温度 ②加入催化剂 ③增大压强
7.(2008·北京理综,12)工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025 Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
解析:因反应是气体体积增大的反应,所以加压会减小SiCl4的转化率,A错;因反应为可逆反应,SiCl4不可能反应1 mol,故达平衡时吸收热量应小于Q kJ,B错;列式计算v(HCl)==0.03 mol/(L·min),v(H2)=v(HCl)=0.015 mol/(L·min),C错误;据热化学方程式比例关系计算,吸收0.025Q kJ能量,则有0.1 mol HCl生成,可中和0.1 mol NaOH,D正确。
答案:D
6.
可逆反应mA(g)+nB(l) pC(g),改变温度(其他条件不变)、压强(其他条件不变)、对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
pC(g),改变温度(其他条件不变)、压强(其他条件不变)、对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
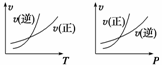
A.m>p,正反应为放热反应
B.m<p,正反应为吸热反应
C.m+n>p,正反应为放热反应
D.m+n>p,正反应为吸热反应
解析:由v-T图像可以看出,升高温度时,逆反应速率增大程度大,说明逆反应为吸热反应,则正反应为放热反应。从v-P图像知,增大压强时,正反应速率增大程度大,考虑到B为液态,则m>p,故选A。
答案:A
5. 一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,发生反应
N2+3H2 2NH3,2
min时测得剩余N2为1
mol,下列表示其化学反应速率正确的是( )
2NH3,2
min时测得剩余N2为1
mol,下列表示其化学反应速率正确的是( )
A.v(N2)=0.25 mol·L-1·min-1 B.v(N2)=0.75 mol·L-1·min-1
C.v(NH3)=1 mol·L-1·min-1 D.v(NH3)=0.25 mol·L-1·min-1
解析:解法一(模式法):求反应速率,需先求物质的量浓度的变化量和反应所耗时间,根据物质的量的变化量与体积可得出物质的量浓度的变化量。
N2 + 3H2 2NH3
2NH3
起始量/mol 2 10 0
2 min末量/mol 1 (10-3) 2
变化量/mol (2-1) 3 2
则v(N2)=(2-1) mol/(2 L×2 min)=0.25 mol·L-1·min-1。
v(H2)=3 mol/(2 L×2 min)=0.75 mol·L-1·min-1。
v(NH3)=2 mol/(2 L×2 min)=0.5 mol·L-1·min-1。
解法二(规律法):
v(N2)==0.25 mol·L-1·min-1。
用不同物质来表示其反应速率时,因为v(N2)∶v(H2)∶v(NH3)=1∶3∶2,
则v(H2)=0.75 mol·L-1·min-1,v(NH3)=0.5 mol·L-1·min-1。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com