
题目列表(包括答案和解析)
2.(2009·四川理综,11)向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )
A.c= B.p=m+ C.n=m+17Vc D.m<p<m
解析:根据题意,反应过程如下:
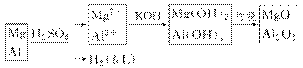
A项,根据电子守恒关系可列出×2=V·10-3·c;B项,p=m+×16;D项,极端假设法,若p g固体全为MgO,则质量为m g;若p g物质全为Al2O3,则质量为 m g,实际应为两者之间;C项应为n=m+17V·10-3·c。
答案:C
1.(2009·北京理综,8)下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
解析:A项,BaCO3、BaSO3都与H+反应,不可能存在于强酸性环境中;B项,加Cu(NO3)2固体后会发生:3Cu+8H++2NO===3Cu2++2NO↑+4H2O的离子反应,铜粉会溶解;C项,发生的反应依次为:Al3++3NH3·H2O===Al(OH)3↓+3NH,Al(OH)3+3H+===Al3++3H2O;D项,Zn+Cu2+===Zn2++Cu,生成的少量Cu附着在Zn粒上,形成Cu-Zn原电池,会加速产生H2的速率。
答案:C
20.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地
开发利用CO2,引起了各国的普遍重视。
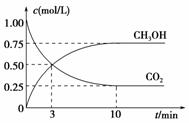
(1)目前工业上有一种方法是用CO2来生产燃料甲醇,为探究反应原理,现进行如下实
验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:
 CO2(g)+3H2(g) CH3OH(g)+H2O(g);
CO2(g)+3H2(g) CH3OH(g)+H2O(g);
ΔH=-49.0 kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
 ①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)。
②该反应的平衡常数表达式为
________________________________________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和3 mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2,某种
电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料,已知该反应的阳极
反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为
________________________________________________________________________。
有人提出,可以设计反应2CO=2C+O2(ΔH>0、ΔS<0)来消除CO的污染,请你判断
是否可行并说出理由
________________________________________________________________________
________________________________________________________________________。
解析:本题综合考查了化学反应速率、化学平衡和电化学知识,氢气的反应速率可根
据图象计算,根据化学平衡常数的表示方法知K=,利用平衡移动原
理分析的变化情况,利用电化学原理分析即可。
答案:(1)①0.225 ② ③CD (2)2CO2+4e-+2H2O===2CO+4OH-
不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行
19.如下图Ⅰ,在恒压密闭容器M中加入2
mol A和2 mol B,起始时容器容积为V
L,发生如下反应并达到化学平衡状态:2A(?)+B(?) xC(g);ΔH<0
xC(g);ΔH<0
平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为y mol。
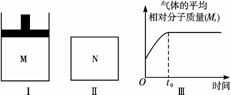
(1)根据题中数据计算,x=________,y=________;
(2)如图Ⅱ,在容积为V L的恒容密闭容器N中发生上述反应(其他条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
|
可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系(M表示摩尔质量) |
|
|
A |
B |
|||
|
① |
是 |
不是 |
z=y |
无法确定 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
解析:(1)设平衡时生成C为nx mol,根据反应可得平衡时A为(2-2n)mol,B为(2-n)mol,nx=y。则有:(2-2n)∶(2-n)∶nx=1∶3∶4,解得n=0.8,x=2,y=1.6。
(2)当A、B均为气体时,该反应的正反应为气体体积减小的反应,恒压比恒容更有利于反应向右进行,故平衡时C的物质的量z<y,此时结合图像Ⅲ可知M(C)=M(A)+M(B),但因M(A)值不确定,所以无法确定M(B)与M(C)相对大小;当A不是气体,B为气体时,该反应正反应为气体体积增大的反应,Ⅰ中保持恒压,而Ⅱ保持恒容,所以反应Ⅰ中压强会小于Ⅱ中压强,所以Ⅰ中保持恒压比Ⅱ中保持恒容更有利于反应向右进行,故平衡时C的量z<y,此时只有B、C两种气体,由图像Ⅲ可知由B生成C,气体平均分子量增大,故M(B)<M(C);因为开始时气体的平均相对分子质量不为0,故不存在A、B均为非气体的情况。
答案:(1)2 1.6
(2)
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
是 |
是 |
z<y |
无法确定 |
|
|
不是 |
是 |
z<y |
M(B)<M(C) |
18. 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如次啊图所示:
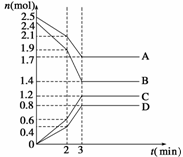
完成下列问题:
(1)该反应的化学方程式为________________________________。
(2)前2 min用A的浓度变化表示的化学反应速率为________。在2 min时,图像发生改变的原因可能是( )
A.增大压强 B.降低温度
C.加入催化剂 D.增加A的物质的量
解析:(1)从前2 min看,A、B、C、D改变的物质的量分别为0.4 mol、0.5 mol、0.6 mol、0.4 mol,且A、B的物质的量减少,应为反应物;C、D的物质的量增加,应为生成物。故方程式为4A+5B 6C+4D。
6C+4D。
(2)前2 min时,V(A)==0.1 mol·L-1·min-1从图像看,2-3 min时的图像斜率变大,说明化学反应速率变快。增大压强、加入催化剂均增大反应速率,降低温度减小反应速率。增加A的用量,虽能加快反应速率,但图像要产生突变。
答案:(1)4A+5B6C+4D
(2)0.1 mol·L-1·min-1 AC
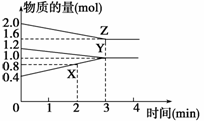
17.某温度时,在3 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如右图
所示。由图中数据分析:
(1)该反应的化学方程式:
________________________________________________________________________;
(2)反应开始至2 min末,X的反应速率为__________;
(3)该反应是由________开始反应的。(填“正反应”、“逆反应”或“正、逆反应同时”)
解析:(1)在时间为“0 min”时X、Y、Z的物质的量分别为0.4 mol、1.2 mol、2.0 mol,在
时间为“3 min”时X、Y、Z的物质的量分别为1.0 mol、1.0 mol、1.6 mol,在0-3 min
内X、Y、Z的物质的量变化分别为:0.6 mol(增加)、0.2 mol(减少)、0.4 mol(减少)。即X、
Y、Z变化的物质的量之比为:n(X)∶n(Y)∶n(Z)=3∶1∶2。根据各物质变化的物质的量之
比等于化学方程式中化学计量数之比,得到化学方程式为:2Z+Y3X。
(2)在时间为“0 min”和“2 min”时,X的物质的量分别为0.4 mol、0.8 mol。即在0-2 min
内X增加的物质的量为0.4 mol。故X的反应速率为:v(X)==0.067 mol/(L·min)。
(3)由于图中X、Y、Z三条曲线均未通过原点,故可断定该反应是由正、逆反应同时开始反
应的。
答案:(1)2Z+Y3X (2)0.067 mol/(L·min) (3)正、逆反应同时
16. 某化学反应2A B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
某化学反应2A B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
温度 |
0min |
10min |
20min |
30min |
40min |
50min |
60min |
|
1 |
820℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
820℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
800℃ |
1.0 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10至20 min时间内平均速率为________mol·(L·min)-1。
(2)在实验2中,A的初始浓度c2=______mol/L,反应经20 min就达到平衡,可推测实验2中还隐含的条件是____________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3____v1(填“>”“=”或“<”),且c3____1.0 mol/L(填“<”“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________
________________________________________________________________________。
解析:(1)v(A)==0.013 mol·(L·min)-1
(2)对比实验1与实验2可知,反应温度相同,达平衡时的A的浓度相同,说明是同一平衡状态,即c2=1.0 mol/L,又因实际反应的速率快,达平衡所需时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min至20 min,实验1的A的浓度变化值为0.13 mol/L,而实验3的A的浓度变化值为0.17 mol/L,这说明了v3>v1。又知从0 min到10 min,A的浓度的变化值应大于0.17 mol/L,即c3>(0.92+0.17) mol/L=1.09 mol/L。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4的A的浓度小,说明了实验④中A进行的程度大,即温度越低,A的转化率越大,说明正反应为放热反应。
答案:(1)0.013 (2)1.0 催化剂 (3)> > (4)放热 温度升高时,平衡向左移动
15. 加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
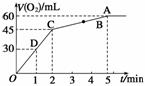
(1)实验时放出气体的总体积是______________。
(2)放出一半气体所需的时间为______________。
(3)反应放出气体所需时间为______________。
(4)A、B、C、D各点反应速率快慢的顺序为________。
(5)解释反应速率变化的原因______________________________________。
(6)计算H2O2的初始物质的量的浓度_________________________________。
(7)求反应到2 min时,H2O2的质量分数_______________________________。
解析:根据V-t图像知,反应进行至1 min时,放出O2的体积为30 mL,反应进行至2 min时,放出O2的体积为45 mL,反应进行至4 min时,放出O2的体积达最大值60 mL;由V-t曲线的斜率变化可知:D、C、B、A的反应速率逐渐减小,这是因为随着反应的进行,c(H2O2)逐渐降低,反应速率逐渐变小;根据:2H2O22H2O+O2↑,由V(O2)=60 mL,则n(H2O2)=×2=0.005 4 mol,所以H2O2的起始物质的量浓度为=0.107 mol/L,反应进行至2 min时,V(O2)=45 mL,消耗H2O2的物质的量为×2=0.004 mol,剩余H2O2的物质的量为0.005 4 mol-0.004 mol=1.40×10-3 mol。
所以w(H2O2)==0.086%。
答案:(1)60 mL (2)1 min (3)2 min (4)D>C>B>A (5)随着反应的进行,c(H2O2)逐渐降低,反应速率逐渐变慢 (6)0.107 mol/L (7)0.086%
14.向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同温度下,发生反应:A(g)+B(g)xC(g);ΔH<0。测得两容器中c(A)随时间t
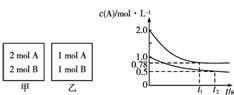 的变化如图所示。下列说法正确的是( )
的变化如图所示。下列说法正确的是( )
A.x不可能等于2
B.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)(平衡常数K只随温度变化
而变化)
C.将乙容器升温可使甲、乙容器内各物质的体积分数相同
D.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中c(A)=1.56 mol/L
解析:本题考查化学平衡问题。由题意可知,甲容器可看作在乙容器的基础上加压,
由坐标系中数据可知,先达到平衡的是甲,甲中A物质的转化率是61%,乙中A物质
的转化率是50%,所以增大压强,平衡向正方向移动,x只能为1,A正确;平衡常数
K只随温度变化而变化,相同温度下,K(甲)=K(乙),B错误;该反应正方向是放热反
应,将乙容器温度升高,平衡向逆方向移动,反应物的体积分数增大,生成物的体积
分数减小,不可能与甲相同,C错误;向甲容器中再充入2 mol A、2 mol B,压强增大,
平衡正向移动,反应物的转化率增大,故平衡时甲容器中A的总浓度0.78
mol/L<c(A)<1.56 mol/L,D不正确。
答案:A
13.CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
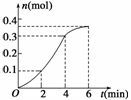
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍
解析:首先要看明白图像,图中的曲线表明,二氧化碳的产生速率先快后慢。在第一个2 min内产生了0.1 mol CO2,第二个2 min内产生了0.2 mol CO2,第三个2 min内产生了0.05 mol CO2,反应速率先增大后减小;先增大是由于反应放热,使溶液温度升高,导致反应速率增大,4 min后速率下降则是由于浓度降低所引起的,通过计算知,A项错误,应该是2 min-4 min的平均速率最大。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com