
题目列表(包括答案和解析)
12.(2009·高考题改编)下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。已知:A、D是单质,且C、E、G中均含有A单质中的元素,B、F、H中均含有D单质中的元素;常温下,除C、E外其他物质均为固体。
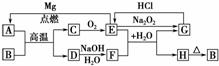
试回答下列问题:
(1)写出下列物质的化学式:A________,H________。
(2)写出下列变化的化学方程式:
E→G________________________________________________________________________,
D→F________________________________________________________________________,
E→A________________________________________________________________________。
(3)B的用途(至少说出一种)____________________________________________________。
解析:单质A与B高温下反应生成单质D与气态化合物C,C可与氧气反应生成E,推测E一定为非金属氧化物,而E又能与Mg反应生成单质A,推测E为CO2,则A为单质碳。CO2与Na2O2反应生成Na2CO3,因为单质D能与NaOH溶液反应,而固态单质能与NaOH溶液反应者,在中学阶段只有Al与Si,Al不能由碳单质与化合物反应制得,所以推断D为Si,则B为SiO2,F为Na2SiO3。而Na2SiO3能与E(CO2)、H2O反应生成Na2CO3与H2SiO3,H2SiO3受热分解生成B。
答案:(1)C H2SiO3 (2)2Na2O2+2CO2===2Na2CO3+O2 Si+2NaOH+H2O===Na2SiO3+2H2↑ 2Mg+CO2C+2MgO (3)制造光导纤维
11. 某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用。 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3]。 |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应__________________________________________________________________;
化合反应_________________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是__________________________________________________。
解释此现象的离子方程式是____________________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿炼锰的原理是(用化学方程式来表示)
________________________________________________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是__________________________________________。
解析:(1)由CuCl2溶液中Cu2+的水解使溶液呈酸性,所以会有2Al+6H+===2Al3++3H2↑,也有2Al+3Cu2+===2Al3++3Cu;单质铜在潮湿空气中由红色变为绿色,化学方程式可写出2Cu+O2+H2O+CO2===Cu2(OH)2CO3。
(2)用石墨作电极,电解AlCl3溶液,电解的方程式为:
2AlCl3+6H2O2Al(OH)3+3H2↑+3Cl2↑
持续电解,电解水,阴极:2H2O+2e-―→H2↑+2OH-从而使阴极区OH-浓度增大,所以会看到有白色沉淀生成,后沉淀逐渐溶解至消失。
(3)①类似于铝热反应
②根据题意可写出离子方程式:MnO2+H2O2+2H+===Mn2++O2↑+2H2O
答案:(1)2Al+6H+===2Al3++3H2↑ 或2Al+3Cu2+===2Al3++3Cu 2Cu+O2+H2O+CO2===Cu2(OH)2CO3 (2)白色沉淀生成,后沉淀逐渐溶解至消失 Al3++3OH-===Al(OH)3↓, Al(OH)3+OH-===[Al(OH)4]- (3)①3MnO2+4Al高温,3Mn+2Al2O3
②MnO2+H2O2+2H+===Mn2++O2↑+2H2O
10.(2008·北京理综,28)由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
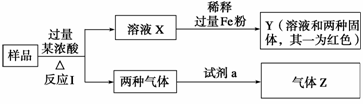
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是__________(填写化学式)。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_____________________________________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是__________。
(3)向Y中通入过量氯气,并不断搅拌,充分反应后,溶液中的阳离子是____________________________________________________________(填写离子符号)。
(4)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(5)另取原样品,加入足量稀硫酸充分反应。若溶液中一定不会产生Y中的红色固体,则原样品中所有可能存在的物质组合是________(各组合中的物质用化学式表示)。
解析:由题干中框图转化的关系可知,Y中必含Cu,另有Fe2+;产生两种气体必须有C。
(1)上层清液中通入CO2无明显现象说明无[Al(OH)4]-,进一步说明样品中无Al。
(2)①Z为一种气体,则必为CO2,说明另一种气体为SO2被NaHCO3溶液除去,浓酸为浓H2SO4,反应为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
②Z为两种气体,a为H2O,则说明浓酸为浓HNO3,Z中气体为NO和CO2。
(3)Cl2+2Fe2+===2Cl-+2Fe3+;2Fe3++Cu===2Fe2++Cu2+循环反应,则溶液中阳离子为Fe3+、Cu2+和Cl2与H2O反应生成的H+。
(4)据题目信息可推知氧化还原反应为:4I-+3H2O2+2Fe2+===2I2+2Fe(OH)3↓
(5)由题意分析无Cu生成,则必定是不发生Cu2++Fe===Cu+Fe2+或2Al+3Cu2+===3Cu+2Al3+的置换反应,说明混合物中无Fe和Al。由题干框图知必含CuO和C。则组合可能为CuO、C;CuO、C、Fe2O3。
答案:(1)Al (2)①C+2H2SO4(浓)CO2↑+2SO2↑+2H2O ②NO、CO2 (3)Cu2+、Fe3+、H+ (4)2Fe2++3H2O2+4I-===2Fe(OH)3↓+2I2 (5)CuO、C或CuO、C、Fe2O3
9. (2009·山东理综,30)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
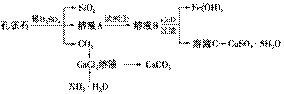
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________。
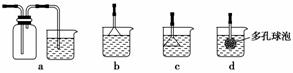
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列________(填代号)装置回收。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到________。用KMnO4标准溶液滴定时应选用________管(填“酸式”或“碱式”)滴定。
解析:(1)由题意分析可知试剂①应为氧化剂,将Fe2+氧化为Fe3+且不能引入新的杂质,故为H2O2;KSCN与Fe3+反应呈明显的血红色。
(2)由溶液到晶体的操作是加热蒸发、冷却结晶、过滤等基本操作;在过滤操作中用到的玻璃仪器除烧杯、漏斗外,还用到玻璃棒,它的主要作用是引流。
(3)应先向CaCl2溶液中加入碱性物质并且不引入新杂质,故应加NH3·H2O。NH3的溶解度很大,应选用一套防止倒吸的装置,故选b。
(4)用容量瓶配制溶液定容时视线应平视凹液面,直到凹液面的最低点与刻度线相切;KMnO4溶液具有强氧化性,能氧化碱式滴定管中的橡胶管,故选用酸式滴定管。
答案:(1)c d (2)冷却结晶 引流 (3)NH3·H2O或NH3 b (4)平视凹液面(或平视刻度线) 凹液面的最低点与刻度线相切 酸式
8.(2008·广东,22)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S6Cu+SO2↑,反应的氧化剂是__________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是__________________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称____________。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:______________________________________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是__________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主要成分是碱式碳酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表面易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
解析:(1)根据矿石的主要成分分析可知:每1 mol Cu中含有的其他元素的质量Cu2S中最小,因此Cu2S中铜的质量分数最高。
(2)根据反应方程式: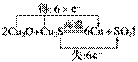 ,可知Cu2O和Cu2S都作氧化剂。
,可知Cu2O和Cu2S都作氧化剂。
(3)SO2排放到大气中会造成酸雨,处理该尾气可得到有价值的化学品:H2SO4或Na2SO4。
(4)粗铜的精炼中,应将粗铜与电源的正极相连作阳极,而将纯铜与电源的负极相连作阴极,用铜盐CuSO4、CuCl2等盐溶液作电解质溶液。
(5)铜绿的成分为Cu2(OH)2CO3,能与盐酸发生反应而除去,而Cu和盐酸不反应,A正确;铜在常温下和浓H2SO4不反应,因此B中前后无因果关系,B错误;在潮湿的空气中铁和铜形成原电池,铁作负极,铜作正极,铁易生锈,因此C也不正确;CuSO4·5H2O晶体转化为CuSO4白色粉末是化学变化,CuSO4为重金属盐,可以使蛋白质变性,因此可以作为消毒剂,因此D正确。
答案:(1)Cu2S (2)Cu2S和Cu2O (3)形成酸雨,会对植物和建筑物等造成严重危害 硫酸、硫酸钠 (4)以硫酸铜→硫酸溶液为电解液。电解时,粗铜(阳极)中的铜以及比铜活泼的金属失去电子进入溶液,不如铜活泼的金属沉入电解槽形成“阳极泥”;溶液中的Cu2+得到电子沉积在纯铜(阴极)上 (5)AD
7. 把镁粉中混入的少量铝粉除去,应选用的试剂是( )
A.盐酸 B.氯水 C.烧碱溶液 D.纯碱溶液
解析:盐酸跟镁、铝都反应,A错;氯水中有氯气和水反应的生成物--盐酸和次氯酸,镁、铝都会与其反应,B错;烧碱是氢氧化钠,铝有两性,可以跟氢氧化钠溶液反应放出氢气,铝变成四羟基合铝酸钠溶于水,镁不反应而分离,2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑,C对;纯碱溶液是碳酸钠溶液,镁、铝都不反应,D错。
答案:C
6.在前一种分散系中慢慢滴加后一种试剂,能观察到先生成沉淀后变澄清的是( )
①氯化铝溶液中滴加氢氧化钠溶液 ②四羟基合铝酸钠溶液中加盐酸 ③氢氧化钠溶液中滴加氯化铝溶液 ④蛋白质溶液中滴入硫酸铜溶液 ⑤氯化铝溶液中滴加氨水 ⑥硝酸银溶液中滴加氨水 ⑦氢氧化铁胶体中滴加硫酸
A.①②⑥⑦ B.②③⑤⑦ C.①②④⑥ D.③④⑤⑥
解析:①先生成Al(OH)3沉淀,再生成可溶性的[Al(OH)4]-;②先生成Al(OH)3,再生成可溶性的Al3+;③先生成[Al(OH)4]-,再生成Al(OH)3,即一段时间后观察到沉淀出现;④蛋白质的变性,观察到有沉淀出现;⑤立即观察到沉淀出现但不会变澄清;⑥先生成AgOH沉淀,再生成可溶性的[Ag(NH3)2]+;⑦胶体的凝聚现象,先出现Fe(OH)3沉淀,再发生酸碱中和,生成Fe3+。
答案:A
5.已知Ba[Al(OH)4]2可溶于水。下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是( )
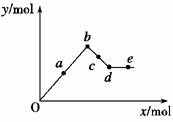
A.a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+多
C.a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
解析:向Al2(SO4)3溶液中滴加Ba(OH)2溶液,开始阶段Al3+与OH-、SO与Ba2+形成沉淀:2Al3++3SO+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓,当Al2(SO4)3与Ba(OH)2的物质的量之比为2∶3时,所有离子恰好完全沉淀,沉淀的物质的量和质量均达到最大,此时对应的点为b点。在O-b范围内,BaSO4的物质的量均比Al(OH)3多;在b点后继续加入Ba(OH)2,Al(OH)3沉淀开始溶解:2Al(OH)3+Ba(OH)2===Ba[Al(OH)4]2,至d点时Al(OH)3完全溶解,那么在b-d范围内BaSO4比Al(OH)3多,[Al(OH)4]-比Ba2+多[溶质是Ba[Al(OH)4]2];d-e时沉淀只有BaSO4,溶质是Ba[Al(OH)4]2和加入的Ba(OH)2,所以
n(Ba2+)可能等于n(OH)-。
答案:BD
4.在硫酸铁溶液中,加入a g铜,完全溶解后,再加入b g 铁,充分反应后得到c g残余固体,且a>c。则下列说法正确的是( )
A.残余固体全部是铜 B.残余固体可能为铁和铜的混合物
C.残余固体是铁,溶液中一定不含Cu2+ D.最后得到的溶液可能含有Fe3+
解析:涉及的反应有①Cu+2Fe3+===Cu2++2Fe2+,②Fe+Cu2+===Fe2++Cu,由于题目中a>c,说明Fe不足,Cu2+没有完全反应掉。故残留固体为Cu,当有单质铜存时,溶液中一定不含有Fe3+。
答案:A
3. 下列各种冶炼方法中,可制得相应金属的是( )
A.加热Al2O3 B.加热CaCO3
C.电解熔融NaCl D.氯化钠与铝粉高温共热
解析:制铝不能通过加热,只能通过电解Al2O3;加热CaCO3只能生成CaO;电解熔融NaCl:2NaCl(熔融)2Na+Cl2↑;NaCl与铝粉高温共热不反应。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com