
题目列表(包括答案和解析)
10.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al
A.全部 B.①③④⑤ C.③④⑤ D.②③④⑤
解析:特殊的两性氧化物Al2O3、两性氢氧化物Al(OH)3及Al既能与强酸反应也能与强碱反应;弱酸酸式盐、NaHCO3及弱酸铵盐(NH4)2SO3也能与强酸、强碱反应。
答案:A
9. 下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
A.NaOH(aq)和Al2(SO4)3 (aq) B.稀盐酸和AgNO3(aq)
C.CaCl2(aq)和Na2CO3(aq) D.Ba(OH)2(aq)和Na2SO4(aq)
解析:只用试管和胶头滴管,不用其他试剂就可以鉴别,意味着互相滴加现象不同,或者加入试剂的量不同时有不同的现象。符合要求的只有A项。
答案:A
8.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易锈蚀。②在人体的血红蛋白中含有铁元素。③铁位于周期表中的第四周期第ⅧB族。④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧。⑤铁与硝酸反应的产物仅是Fe(NO3)3。⑥不能通过化合反应生成FeCl2和Fe(OH)3。
A.①③ B.②④ C.②⑤ D.④⑥
解析:①中纯铁不易被锈蚀;③中Fe位于第Ⅷ族,而不是ⅧB族;⑤中当铁过量时可生成Fe(NO3)2;⑥可以通过化合反应生成FeCl2和Fe(OH)3,2FeCl3+Fe===3FeCl2,4Fe(OH)2+O2+2H2O===4Fe(OH)3。
答案:B
7.复合材料制成的防弹头盔能抵御多种手枪子弹的射击,最大限度地保护使用人员的安全,这利用了复合材料的( )
A.高强度质量轻 B.耐热抗高温 C.耐腐蚀稳定性好 D.导电、导热性好
解析:质轻可减轻装备重量,高强度有很好的抗撞击能力,可有效地发挥保护作用。
答案:A
6. 将相同物质的量的镁和铝混合,取相同质量的该混合物4份,分别加入到足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol·L-1 HCl B.4 mol·L-1 HNO3 C.8 mol·L-1 NaOH D.18 mol·L-1 H2SO4
解析:稀HNO3具有强氧化性,与Mg、Al反应均不产生氢气,故B选项排除;Al具有两性,能与NaOH溶液反应产生H2,而Mg不与NaOH溶液反应,故C选项排除;18 mol·L-1 H2SO4是浓H2SO4,常温下与Al接触形成钝化膜起保护作用,不与Al继续反应,故D选项也应排除;因此只有3 mol·L-1 HCl既能与Mg反应放出氢气,也能与Al反应放出氢气,所以充分反应后放出氢气最多的是3 mol·L-1 HCl。
答案:A
4.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:
①2MoS2+7O22MoO3+4SO2;
②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;
④H2MoO4MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是( )
A.MoS2煅烧产生的尾气可直接排入空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
解析:A项,MoS2煅烧产生的SO2是大气污染物,不能直接排入空气,A不正确;B项,MoO3和氨水反应表现出酸性氧化物的性质,B不正确;C项,H2MoO4不溶于水,受热易分解,不是强酸,C不正确;D项还原1 mol MoO3得6 mol电子,消耗H2、CO、Al的物质的量分别为∶∶=3∶3∶2。
答案:D
5 向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论错误的是( )
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶2 D.1 mol Fe可还原2 mol Fe3+
解析:根据金属活动顺序表,银的还原性较差,一旦失去电子变成银离子其氧化性较强。铁粉先跟银离子反应,然后再与三价铁离子反应,由反应方程式或电子守恒得,银离子、三价铁离子完全反应后铁粉没有剩余,B、C选项正确。一个铁失两个电子,一个三价铁离子得一个电子,所以1 mol铁可还原2 mol三价铁离子。
答案:A
3. 选用金属材料时,以下方面需要考虑的是( )
①主要用途 ②物理性质、化学性质 ③价格 ④加工难度 ⑤日常维护 ⑥环境保护
A.①②③ B.③④⑤ C.①⑤⑥ D.①②③④⑤⑥
解析:在选用材料时,要综合考虑所选材料的性能、价格、制造或安装成本等,从众多材料中选取最合适者。
答案:D
2. 1 L某混合溶液中,溶质X、Y的浓度都为0.1 mol·L-1,向混合溶液中滴加某溶液Z(0.1 mol·L-1的氢氧化钠溶液或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是( )

A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.四羟基合铝酸钠、氢氧化钡、硫酸
D.四羟基合铝酸钠、氯化钡、硫酸
解析:本题图像可以分成两部分,以加入Z溶液1 L为界。加入1 L之后的图像,应为在Na[Al(OH)4]溶液中逐滴加入酸,所以可以排除A、B两项。然后分析图像可知,沉淀生成的曲线幅度不同,即反应是分步发生的。
答案:C
1.合金比纯金属制成的金属材料的优点是( )
①合金的硬度一般比它的各成分金属的大 ②一般地,合金的熔点比它的各成分金属的更低③改变原料的配比、改变生成合金的条件,得到有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④ C.①②④ D.①②④⑤
解析:合金的机械性能比各成分金属的大,故①正确;根据教材知识,②③是正确的;合金的电阻率比纯金属要大,故④是错误的;合金由于性能好而应用更广泛,⑤是正确的。
答案:A
13.(2009·福建理综,24)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为________________。
(2)流程乙加入烧碱后生成SiO的离子方程式为________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入________________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途________________________________________________________________________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12(mol/L)3。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的
c(Mg2+)________。
解析:流程甲为:

流程乙为:
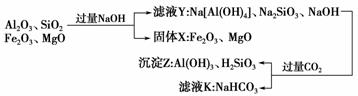
则滤液E、K中溶质主要成分是NaHCO3,该物质可用于作发酵粉、制纯碱等。(5)由Mg(OH)2的溶度积常数Ksp=5.6×10-12=[OH-]2·[Mg2+]2可推知:[Mg2+]= mol·L-1=5.6×10-10 mol·L-1。
答案:(1)Al2O3+6H+===2Al3++3H2O (2)SiO2+2OH-===SiO+H2O (3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案) (4)NaHCO3 制纯碱或作发酵粉等合理答案
(5)5.6×10-10 mol·L-1

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com