
题目列表(包括答案和解析)
20.某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2
054 |
1
535 |
1
462 |
|
沸点/℃ |
2
467 |
2
980 |
2
750 |
- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?__________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为__________________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
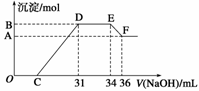
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________________________________________________________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为________________________________________________________________________;
上述现象说明溶液中________结合OH-的能力比________强(填离子符号)。
(3)B与A的差值为________mol。
(4)B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为________mL。
解析:Ⅰ.由表中数据比较可知,铝的熔点比铁低,该反应放出的热量使铁熔化,此时液态的铁和铝熔合形成铁铝合金。利用金属Al和碱液反应放出氢气的性质即可验证。由于Fe和Al都是活泼的金属,所以可以用稀硫酸或者稀盐酸溶解。Ⅱ.由图像可知硝酸过量,OC段发生酸碱中和反应,CD段为Fe(OH)3、Al(OH)3沉淀的生成,DE段消耗了NaOH,由此证明硝酸和金属反应的还原产物为较低价态的NH,EF段为Al(OH)3的消失,只剩下Fe(OH)3沉淀。B与A的差值为Al(OH)3,为4 mol·L-1×(36-34)×10-3 L=0.008 mol,参加反应的n(Al)=0.008 mol,因为1 mol的Al3+、Fe3+均与3 mol的NaOH反应,由电子守恒可知Fe和Al化合价升高的总数=HNO3生成NH降低的总数,即3n(Fe)+3n(Al)=n(NH)×8=4 mol·L-1×(34-31)×10-3 L×8,解得n(Fe)+n(Al)=0.032 mol,n(Fe)=0.024 mol,两种沉淀的物质的量为0.032 mol。生成两种沉淀共消耗n(NaOH)=0.032 mol×3=0.096 mol,所以C点体积为:
31 mL-×103 mL·L-1=7 mL。
答案:Ⅰ.(1)合理 (2)NaOH溶液 2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑ (3)B Ⅱ.(1)H++OH-===H2O (2)NH+OH-===NH3·H2O Al3+、Fe3+、H+ NH
19. 将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L的H2SO4溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:
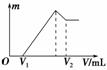
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,则金属粉末中n(Mg)=__________mol,V2=________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀安全,则滴入NaOH溶液的体积V(NaOH)=________mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量为a,用100 mL 2 mol/L的H2SO4溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
思路分析:在明确图像中各折点代表的含义的基础上,运用解方程组,以及SO守恒,
Na+守恒等原理进行求解。
解析:(1)由图像可以看出镁铝混合物与H2SO4反应,H2SO4是过量的。则有
解得
NaOH溶液体积为V2时溶液中溶质为Na2SO4和Na[Al(OH)4],根据守恒关系
V2×1 mol/L=2×0.1 L×2 mol/L+0.04 mol,V2=0.44 L=440 mL
(2)Mg(OH)2、Al(OH)3刚好沉淀时溶液中溶质里有Na2SO4,根据SO守恒关系,故有:
V×1 mol/L=2×0.1 L×2 mol/L,V=0.4 L=400 mL
(3)当沉淀中恰好只有Mg(OH)2时,加入的NaOH全部生成Na2SO4和Na[Al(OH)4],根据Na+守恒可得如下关系式:
解得0.05 mol≤a<0.1 mol
答案:(1)0.06 440 (2)400 (3)0.05 mol≤a<0.1 mol
18.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
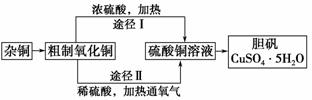
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________
上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在
________上,不能直接放在桌面上。
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚坩 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是
________。
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、
过滤、________、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是
________________、________________。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,称量操作至少进行________
次。
(6)若测定结果x值偏高,可能的原因是________。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
思路分析:首先明确命题意图,在考查Cu及其化合物性质及转化关系的同时,考查绿色化
学铜及氧化铜的
性质,经过周密而有序地思维,认真作答。
解析:(1)因坩埚加热后温度较高,应放在泥三角上进行加热,且取用坩埚时要用坩埚钳,
并且为防止坩埚炸裂和烧坏桌面,烧后的坩埚要在石棉网上冷却,不能直接放在桌面上。
(2)灼烧后含有少量铜,其原因可能是灼烧不充分,铜未被完全氧化,也可能是灼烧过程中
部分氧化铜被还原。
(3)利用途径Ⅱ制取胆矾时,必须先加酸将氧化铜溶解,加热通氧气将Cu氧化,过滤除去
粗制氧化铜中的不溶物杂质后,然后再蒸发溶剂,冷却结晶,再过滤得晶体,最后将其
干燥,由此可写出答案。
(4)根据途径Ⅰ的反应方程式Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O和途径Ⅱ的反应
方程式2Cu+O2+2H2SO4(稀)2CuSO4+2H2O,可以看出途径Ⅱ的优点是:①产生等
量的胆矾比途径Ⅰ耗硫酸少;②途径Ⅱ不产生污染大气的气体(SO2)。
(5)称量操作至少进行4次,分别是①称量坩埚;②称量加入晶体后的坩埚;③称量加热冷
却后的坩埚;④称量再加热、再冷却后的坩埚至两次称量的值相差不超过0.1 g。
(6)若测定结果x值偏高,可能是加热温度过高使CuSO4晶体中的CuSO4分解了,其他三项
均使x值偏低。
答案:(1)c e b (2)a、b (3)蒸发 过滤 (4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ
不会产生污染大气的气体 (5)4 (6)a
17.奥运五环代表着世界五大洲,五色代表的是世界五大洲不同肤色的人民,五环连在一起代 表着五大洲的人们能够友好相处。

上图所示五元环代表A、B、C、D、E五种常见的物质,而且A、B、C、D、E这五种物质含有同一种元素,两圆圈交叉是指两种物质之间可以转化,其中A是地壳中含量最多的金属元素的单质;B是一种常见的氧化物;对C的水溶液加热、蒸干、灼烧即可得B;D难溶于水,这种物质的生成是明矾净水的主要原因。
(1)试推测A是________,C是________(写化学式)。
(2)由B生成A需要电解才能达到目的,当生成1 mol A时转移电子的物质的量为__________。
(3)C是一种强酸盐,其水溶液呈酸性,用离子方程式解释其原因________________________________________________________________________。
解析:本题以“五元环中交叉环之间可相互转化或有相同元素”作为信息,围绕这一信息关系,考查物质的推断。
(1)①由题意可知,A是铝;B是氧化铝;C是一种挥发性酸的铝盐(如氯化铝);D是氢氧化铝;E是四羟基合铝酸盐。
(2)由B到A是氧化铝到铝的过程,需要电解,根据电解的化学方程式可知,当生成1 mol铝时需转移3 mol的电子。
(3)C是强酸盐,同时又必须是挥发性酸的铝盐,所以可以是氯化铝,溶液呈酸性是由于铝离子水解。
答案:(1)Al AlCl3[或Al(NO3)3] (2)3 mol (3)Al3++3H2OAl(OH)3+3H+
16.铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响,请完成(1)-(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)跟铁反应生成铜]。试写出该反应的化学方程式:______________________________________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:________________________________________________________________________,
这层铜绿可以用化学方法除去。试写出除去铜绿而不损伤器物的化学方程式:________________________________________________________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4℃,铁的熔点是1 534.8℃)
分析:本题考查了铜的化合物的性质,有关铜的冶炼方法,同时考查了有关铜的物理性质和化学性质的应用。
解析:(1)Fe+CuSO4===FeSO4+Cu
(2)2Cu+O2+H2O+CO2===Cu2(OH)2CO3;要除去铜器表面的铜绿,考虑选择酸,强氧化性酸能和裸露的铜继续反应,而盐酸不和铜继续反应,并且盐酸具有挥发性。有关方程式如下:
Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O。
(3)根据题给信息以及做货币的实际,选择铜做货币是因为铜的熔点比较低,容易冶炼铸造成型;铜的化学性质比较稳定,不易被腐蚀。
答案:(1)Fe+CuSO4===FeSO4+Cu (2)2Cu+O2+H2O+CO2===Cu2(OH)2CO3
Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O (3)选择铜做货币是因为铜的熔点比较低,容易冶炼铸造成型;铜的化学性质比较稳定,不易被腐蚀。
15.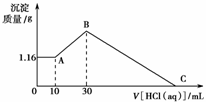 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于
足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴
加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与
生成沉淀的质量m的关系如图所示,试回答:
(1)A点沉淀物的化学式为________;B点沉淀物的化学式为________。
(2)原混合物中的MgCl2的物质的量为________,AlCl3的物质的量为________,NaOH的物
质的量为________。
(3)HCl溶液在C点的加入量是________。
解析:(1)盐酸加入量在0-10 mL时,沉淀的质量没有改变,说明未加盐酸时,沉淀物为
Mg(OH)2,溶液为NaAlO2和NaOH的混合液,其过程中加盐酸是中和剩余的NaOH,A
处的悬浊液为Mg(OH)2、NaAlO2、NaCl,则原混合物中n(MgCl2)=1.16 g/58 g·mol-1=0.02
mol。
(2)加入盐酸10-30 mL过程时,发生反应为:AlO+H++H2O===Al(OH)3↓,B沉淀的化
学式为Mg(OH)2、Al(OH)3,原溶液中n(AlCl3)=(30-10)×10-3 L×1 mol/L=0.02 mol,B
点沉淀量达到最大值,其中溶液为NaCl溶液。所以n(NaOH)=n(HCl)=30×10-3 L×1
mol/L=0.03 mol。
(3)设Mg(OH)2、Al(OH)3完全溶解时,所消耗盐酸的体积为V′,V′×10-3 L/mL×1 mol/L =0.02 mol×2+0.02 mol×3,∴V′=100 mL,∴C点表示加入了130 mL的盐酸。
答案:(1)Mg(OH)2 Mg(OH)2、Al(OH)3 (2)0.02 mol 0.02 mol 0.03 mol (3)130 Ml
14.把①钢铁,②Cu,③陶瓷,④光纤,⑤氮化硅陶瓷、⑥金,⑦水泥,⑧合成纤维,⑨玻璃钢,⑩塑料等材料按分类填写在下列横线上(填写序号):
(1)黑色金属材料________________________________________________________。
(2)有色金属材料_________________________________________________________。
(3)传统无机非金属材料_________________________________________。
(4)新型无机非金属材料_______________________________________________。
(5)复合材料_______________________________________________________________。
(6)有机合成材料__________________________________________________________。
解析:钢铁属于黑色金属材料;铁、铬、锰以外的金属如铜和金是有色金属;陶瓷水泥等
为传统无机非金属材料;光纤、氮化硅陶瓷等为新型无机非金属材料;玻璃钢是用玻璃纤
维做增强体,合成树脂做基体的复合材料;而合成纤维和塑料则为有机合成材料。
答案:(1)① (2)②⑥ (3)③⑦ (4)④⑤ (5)⑨ (6)⑧⑩
13.某化学兴趣小组用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是( )
A.常温下与足量18 mol·L-1 H2SO4溶液反应,最多可放出0.6 mol H2
B.常温下与足量2 mol·L-1 HNO3溶液反应,最少可放出0.45 mol H2
C.常温下与足量2 mol·L-1 H2SO4溶液反应,放出H2的物质的量在0.45 mol-0.6 mol之
B间
D.常温下与足量2 mol·L-1 NaOH溶液反应,放出H2的物质的量在0.45 mol-0.6 mol
之间
解析:A、B项中的酸与镁铝合金反应不产生H2;C、D项应利用极值法解决,若10.8 g全为Mg,则放出H2为0.45 mol,若10.8 g全为Al,则放出H2为0.6 mol,由于10.8 g为镁铝的混合物,故放出H2的物质的量在0.45 mol-0.6 mol之间,C项正确;D项中只有铝与碱反应,只能确定放出的H2小于0.6 mol。
答案:C
12.把Ba(OH)2溶液滴入明矾溶液中,使SO全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+ B.Al(OH)3 C.[Al(OH)4]- D.Al3+和Al(OH)3
解析:明矾的化学式为KAl(SO4)2·12H2O,当SO全部转化成BaSO4沉淀时,Ba(OH)2与KAl(SO4)2·12H2O的物质的量之比为2∶1,此时Al3+与OH-的物质的量之比为1∶4,所以铝元素主要是以[Al(OH)4]-形式存在,故选C。
答案:C
11.将Na2O2逐渐加入到含有Al3+、Mg2+、NH的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示,则原溶液中Al3+、Mg2+、NH的物质的量分别为( )
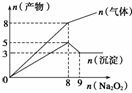
A.2 mol、3 mol、8 mol B.3 mol、2 mol、8 mol
C.2 mol、3 mol、4 mol D.3 mol、2 mol、4 mol
解析:由2Na2O2+2H2O===4NaOH+O2↑,Al(OH)3+NaOH===Na[Al(OH)4]+2H2O,故n(Al3+)=(9-8)×2=2 mol,根据图像可知,生成8 mol气体,消耗8 mol Na2O2(其中4 mol为O2),故n(NH)=n(NH3)=4 mol,n(Mg2+)==3 mol。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com