
题目列表(包括答案和解析)
9. 把温度为13℃、浓度为1.0 mol/L的酸溶液和1.1 mol/L的碱溶液各50 mL混合[溶液密度均为1 g/mL,所生成溶液的比热容c=4.184 J/(g·℃)],轻轻搅动。测得酸碱混合液的温度变化数据如下:
|
反应物 |
起始温度t1/℃ |
终了温度t2/℃ |
中和热kJ·mol-1 |
|
HCl+NaOH |
13.0 |
19.8 |
ΔH1 |
|
HCl+NH3·H2O |
13.0 |
19.3 |
ΔH2 |
(1)试计算上述两组实验测出的中和热:
ΔH1=__________;ΔH2=______________。
(2)实验中碱液过量的目的是___________________________________________________。
(3)两组实验结果有差异的原因是________________________________________________。
解析:(1)根据给出的酸和碱的物质的量,酸为0.050 mol,碱为0.055 mol,碱是过量的,应以酸计算,算出生成0.050 mol 水放出的热量,进而得出生成1 mol水放出的热量,即可得出两组实验测出的中和热数值。
|ΔH1|==5.69×104 J/mol=56.9 kJ/mol
|ΔH2|==5.27×104 J/mol=52.7 kJ/mol
(2)碱液过量是为了提高实验准确度,保证盐酸完全反应;NH3·H2O易挥发,也使NH3·H2O浓度下降,故应过量。
(3)NaOH是强碱,在水溶液中完全电离,跟HCl中和时放热较多,NH3·H2O是弱碱,只有小部分电离,发生电离时要吸热,中和时放热较少。
答案:(1)-56.9 kJ·mol-1 -52.7 kJ·mol-1
(2)使盐酸完全反应,提高实验的准确度
(3)NaOH是强电解质,NH3·H2O是弱电解质,继续电离时吸收热量
8. 在量热计中(如图)将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。
(1)试求CH3COOH的中和热ΔH。
(2)CH3COOH的中和热的文献值为56.1 kJ·mol-1,你认为(1)中测得的实验值有偏差可能的原因是________________________________________________________________________
________________________________________________________________________。
(3)实验中NaOH过量的目的是________________________________________________
________________________________________________________________________。
(4)你认为CH3COOH的中和热与HCl的中和热数值相比,________较大,其原因是________________________________________________________________________。
解析:CH3COOH的中和热
ΔH=-
=-5.33×104 J·mol-1=-53.3 kJ·mol-1
答案:(1)ΔH=-53.3 kJ·mol-1 (2)①量热计的保温瓶绝热效果不好;②酸碱溶液混合不迅速;③温度计不够精确等 (3)过量的碱能保证CH3COOH完全被中和,从而提高实验准确度
(4)HCl CH3COOH是弱酸,只是少部分电离,CH3COOH发生电离时要吸热,中和时放热较少
7.已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量;③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1
解析:氢气和氯气生成氯化氢的反应热等于氢气键能加氯气键能减去氯化氢键能的2倍即ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,故氢气和氯气反应生成氯化氢的热化学方程式:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1。
答案:C
保温杯式量热计
6. 现有如下三个热化学方程式:
H2(g)+O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于它们的表述正确的是( )
A.它们都是吸热反应 B.a,b和c均为正值
C.a=b D.2b=c
解析:根据热化学方程式书写中反应热表示方法的规定,即ΔH为“-”表示放热,ΔH为“+”表示吸热,可判断H2燃烧放出的热量应该用负值表示,故A、B均不正确。根据相同物质的反应,聚集状态不同,反应热不同,可判断a≠b,故C不正确。根据相同反应,反应热与反应物的物质的量成正比,可判断2b=c,D正确。
答案:D
5.已知:CH3CH2CH2CH3(g)+6.5 O2(g)===4CO2(g)+5H2O(l);ΔH=-2 878 kJ/mol
(CH3)2CHCH3(g)+6.5 O2(g)===4CO2(g)+5H2O(l);ΔH=-2 869 kJ/mol
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
解析:燃烧放出的热量等于反应物的能量减去产物的能量,由两个热化学方程式知正丁烷的能量大于异丁烷,其稳定性小于异丁烷,所以异丁烷转化为正丁烷需要吸热,但正丁烷与异丁烷的碳氢键一样多,故选A。
答案:A
4.(2009·天津理综,6)已知:2CO(g)+O2(g)===2CO2(g);ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
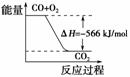
A.CO的燃烧热为283 kJ
B.上图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)
ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023
解析:A错,燃烧热的单位应是kJ/mol;B项,图中没有标注物质的系数;C项,由CO2(s)===CO2(g) ΔH>0及盖斯定律可知C项正确;D项,当反应放出509 kJ热量时,参加反应的CO为1 mol,转移电子数为2×6.02×1023。
答案:C
3.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥弱酸电离 ⑦NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
A.②③④⑤ B.①⑥⑦ C.②③④ D.①③⑤
解析:弱电解质的电离是吸热过程。
答案:A
2. 1 g氢气燃烧生成液态水时放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)===2H2O(l) ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
C.2H2+O2===2H2O ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l) ΔH=+571.6 kJ·mol-1
解析:因反应为放热,淘汰D;热化学方程式应标明所有物质的聚集状态,淘汰C;因1 g氢气燃烧生成液态水放出142.9 kJ热量,那么4 g氢气燃烧生成液态水应放出571.6 kJ热量,淘汰A。
答案:B
1.(2009·全国Ⅱ理综,11)已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ,则原混合气体中H2与CH4的物质的量之比为( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
解析:解法一:设H2与CH4的物质的量分别是x和y,则x+y=112/22.4,+890y=3 695,解得x=1.25 mol,y=3.75 mol,故原混合气体中H2与CH4物质的量之比是1∶3。
解法二:十字交叉法,混合气体共=5 mol,其平均燃烧热为=739 kJ·mol,则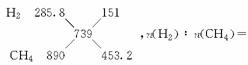 n(H2)∶n(CH4)=≈1∶3。
n(H2)∶n(CH4)=≈1∶3。
答案:B
0.(3)0.008 (4)032 7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com