
题目列表(包括答案和解析)
8.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
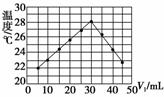
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
解析:实验所测量的温度不是环境温度,而是反应后溶液的温度;根据图像,当V1=30 mL时,反应混合液温度最高,说明此时二者恰好完全反应,V2=20 mL,1.00 mol·L-1×30 mL=c(NaOH)×20 mL,c(NaOH)=1.5 mol·L-1;NH4Cl(s)与Ba(OH)2·8H2O(s)的反应也有水生成,但该反应是吸热反应。
答案:B
7. 化学反应中的能量变化通常表现为热量的变化,下列图示能表示Ba(OH)2·8H2O与NH4Cl的反应过程中能量变化的是( )
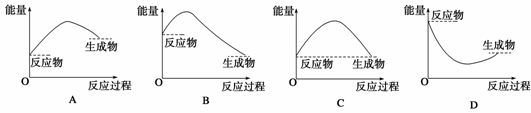
解析:Ba(OH)2·8H2O与NH4Cl反应过程中吸收热量,即生成物的总能量大于反应物的总能量。
答案:A
6. 盖斯定律认为:不管化学反应是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)===H2O(l);ΔH1=-Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l);ΔH2=-Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH3=-Q3 kJ·mol-1
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3
解析:23 g酒精为0.5 mol,汽化吸热0.5 Q2 kJ,0.5 mol酒精生成H2O 1.5 mol,H2O液化放热1.5Q1 kJ,故23 g酒精液体完全燃烧放出的热量应为:(1.5Q1-0.5Q2+0.5Q3) kJ。
答案:D
5. 已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)===CO2(g);ΔH=-393.51 kJ·mol-1
C(金刚石,s)+O2(g)===CO2(g);ΔH=-395.41 kJ·mol-1
据此判断,下列说法中正确的是( )
A.由于石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的能量低
B.由于石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的能量高
C.由于石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的能量低
D.由于石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的能量高
解析:用石墨燃烧的热化学方程式减去金刚石燃烧的热化学方程式得:
C(石墨,s)===C(金刚石,s);ΔH=+1.9 kJ·mol-1,由于ΔH>0,所以石墨制备金刚石是吸热反应,即石墨吸收能量才能成为金刚石,故石墨的能量比金刚石的能量低。
答案:A
4. 实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)2SO3(g);ΔH=-196.64 kJ/mol,当放出314.624 kJ热量时,SO2的转化率为( )
A.40% B.50% C.80% D.90%
解析:当放出热量为314.624 kJ时,参加反应的SO2的物质的量为×2 mol=3.2 mol,故SO2的转化率为:×100%=80%。
答案:C
3.在101 kPa时燃烧1 t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106 kJ的热量,表示上述反应的热化学方程式正确的是( )
A.4FeS2(s)+11O2(g)===2Fe2O3(s)+8SO2(g);ΔH=+853.7 kJ·mol-1
B.FeS2(s)+11/4O2(g)===1/2Fe2O3(s)+2SO2(g);ΔH=-853.7 kJ·mol-1
C.4FeS2(s)+11O2(g)===2Fe2O3(s)+8SO2(g);ΔH=+3 414.8 kJ·mol-1
D.FeS2(s)+11/4O2(g)===1/2Fe2O3(s)+2SO2(g);ΔH=-3 414.8 kJ·mol-1
解析:燃烧1 mol FeS2放热:×120 g=853.7 kJ。D项ΔH与化学计量数不匹配。
答案:B
2.氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)2H2(g)+O2(g),该反应要吸收大量的热。关于用水制取二级能源氢气,以下研究方向正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢气成为二 级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氧气
解析:水本身并不能燃烧,水分解后生成H2,才可以燃烧放出热量,而水的分解是吸热反应,在发生吸热反应时,反应物需要吸收能量才能转化成生成物。
答案:B
1.(2009·潍坊统考)将1 g H2和4 g O2混合点燃,充分反应,放出71.45 kJ热量,同样条件下1 mol H2在O2中完全燃烧放出的热量是( )
A.71.45 kJ B.142.9 kJ C.571.6 kJ D.285.8 kJ
解析:由氢气和氧气的反应知,1 g H2和4 g O2反应时氢气过量,故1 mol H2反应时需16 g氧气,所以放出热量为4×71.45 kJ=285.8 kJ。
答案:D
11.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如右图所示(图中的ΔH表示生成1 mol产物的数据)。

根据右图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是____________________________________
________________________________________________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是____________________________________
_______________________________________________________________________。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_______________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”“小于”或“等于”)。
解析:(1)产物的总能量减去反应物的总能量就等于反应热,结合图像可知,PCl3和反应物P和Cl2的能量差值为306 kJ,因此该热化学反应方程式为:
P(s)+Cl2(g)===PCl3(g);ΔH=-306 kJ/mol。
(2)根据图像可知PCl5和PCl3之间的能量差值为:93 kJ,因此PCl5分解成PCl3和Cl2的热化学方程式为:PCl5(g)===PCl3(g)+Cl2(g);ΔH=+93 kJ/mol。
(3)由于两个反应都是放热反应,降低温度有利于平衡右移,提高产率。同时由于PCl5受热易分解,因此温度降低防止其分解。
(4)根据盖斯定律求得:ΔH3=-399 kJ/mol。且ΔH3=ΔH4,与反应的途径无关,只与起始物质、终了物质有关。
答案:(1)Cl2(g)+P(s)===PCl3(g);ΔH=-306 kJ/mol
(2)PCl5(g)===PCl3(g)+Cl2(g);ΔH=+93 kJ/mol
(3)两步反应均为放热反应,降温有利于提高产率,防止生成物分解 (4)-399 kJ/mol
等于

10.(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水蒸气。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式是________________________________________________________________________。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个热化学方程式:________________________________________________________________________。
(3)家用液化气中的主要成分之一是丁烷,当10 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,试写出丁烷燃烧的热化学方程式:________________________________________________________________________。
丁烷的燃烧热为________kJ·mol-1。已知1 mol液态水汽化时需要吸收44 kJ的热量,则反应:
C4H10(g)+O2(g)===4CO2(g)+5H2O(g)的ΔH=________kJ·mol-1。
解析:根据燃烧热的概念,结合题给条件可计算丁烷的燃烧热为:×58 g·mol-1=2 900 kJ·mol-1。1 mol丁烷燃烧生成气态水时ΔH=-(2 900 kJ·mol-1-44×5 kJ·mol-1)=-2 680 kJ·mol-1。
答案:(1)SiH4(g)+2O2(g)===SiO2(s)+2H2O(g);ΔH=-1 427.2 kJ·mol-1
(2)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g);ΔH=-290 kJ·mol-1
(3)C4H10(g)+O2(g)===4CO2(g)+5H2O(l);ΔH=-2 900 kJ·mol-1 2 900 -2 680
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com