
题目列表(包括答案和解析)
17.将煤转化为水煤气的主要化学反应为C(s)+H2O(g)CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-242.0 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:________________________________________________________________________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出右面循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是__________(填“甲”或“乙”);判断的理由是________________________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点________________________________________________________________________
________________________________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
解析:根据盖斯定律将方程式合并即可得C(s)+H2O(g)===CO(g)+H2(g);ΔH=+131.5 kJ·mol-1,由此可知煤转化成水煤气是吸热反应,而甲正是忽略了这个问题,才误认为“煤转化成水煤气可以使煤燃烧放出更多的热量”。CO和H2按1∶1反应合成物质时,可达到零排放,符合“绿色化学”的要求,则合成的物质的最简式应满足CH2O,则②、④符合。
答案:(1)C(s)+H2O(g)===CO(g)+H2(g);ΔH=+131.5 kJ·mol-1
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3,且ΔH2>0)
(3)①减少污染 ②燃烧充分 ③方便运输(任写两个) (4)②④
16.近20年来,对以氢气作为未来的动力燃料氢能源的研究得到了迅速发展,像电一样,
氢是一种需要依靠其他能源,如石油、煤、原子能等的能量来制取的“二级能源”,
而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能
和原子能。发展民用氢能源,首先必须制得廉价的氢气。
(1)下列可供开发又较经济且可持续利用的制氢气的方法是( )
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
H2(g)+O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1
C(g)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是:__________。
(3)氢能源既可能实现能源贮存,也可能实现经济、高效的输送。研究表明过渡金属型
氢化物(又称间充化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成
不固定,通常是非化学计量的,如:TiH1.73、LaH0.78。已知标准状况下,1体积的钯粉
(Pd)可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3,相对原子量为106.4)试写出
Pd的氢化物的化学式:__________。
解析:(1)光解水法,利用特殊的催化剂、模拟生物光合作用制取氢气,都是较经济且
资源可持续利用的制氢方法。
(2)由热化学方程式可知,等质量的氢气和碳完全燃烧的热量之比为4.36∶1
(3)n(Pd)∶n(H)=1∶0.8。
答案:(1)C (2)4.36∶1 (3)PdH0.8
0.50 mol/L)与氢氧化钠(50 mL 0.55 mol/L)完全反应后生成的水的物质的量
(50 mL×0.55 mol/L)比原先(50 mL×0.50 mol/L)多,所以放出的热量多,但中和热不变
答案:(1)减少热量损失 (2)不能 ①铁会和盐酸反应②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等 (4)NaOH(aq)+HCl(aq)===NaCl(aq)+
H2O(l);ΔH=-57.3 kJ·mol-1
15.用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如右图所示的装置中
进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是
________________________________________________________________________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?________(填“能”或“不能”),其原
因是___________________________________________________________;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是
________________________________________________________________________;
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,
与上述实验相比,所放出的热量____________(填“相等”“不相等”),若实验操作均
正确,则所求中和热________________(填“相等”“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,
则上述反应的热化学方程式为:
________________________________________________________________________。
解析:考查学生对中和热测定的实验能力、对出现问题的分析和理解能力,热化学方
程式的书写、误差分析等。由于本实验的关键是如何防止热量的损失,所以填充大量
泡沫、使用玻璃搅拌器、稍过量的氢氧化钠等;(3)中由于参加反应的盐酸(60 mL
14.(2008·海南,8)白磷与氧可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸
收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P===O c kJ·mol-1、O===
O d kJ·mol-1。
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
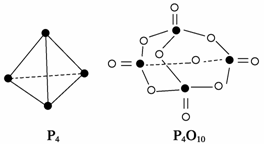
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
解析:化学反应的实质是旧键断裂新键形成,其中旧化学键断裂吸收能量,新化学键
形成释放能量,反应方程式P4+5O2===P4O10中有6 mol P-P键和5 mol O===O键断
裂,同时生成4 mol P===O键和12 mol P-O键,因此ΔH=(6a+5d-4c-12b)
kJ·mol-1。
答案:A
13.(2008·重庆理综,13)化学反应N2+3H2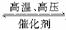 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
 A.N2(g)+3H2(g) 2NH3(l);
A.N2(g)+3H2(g) 2NH3(l);
ΔH=2(a-b-c) kJ·mol-1
 B.N2(g)+3H2(g) 2NH3(g);
B.N2(g)+3H2(g) 2NH3(g);
ΔH=2(b-a) kJ·mol-1
 C.
N2(g)+H2(g) NH3(l);ΔH=(b+c-a) kJ·mol-1
C.
N2(g)+H2(g) NH3(l);ΔH=(b+c-a) kJ·mol-1
 D.
N2(g)+H2(g) NH3(g);ΔH=(a+b) kJ·mol-1
D.
N2(g)+H2(g) NH3(g);ΔH=(a+b) kJ·mol-1
解析:通过图分析起点 mol N2(g)+ mol H2(g),变化三阶段为①吸收能量a kJ;②放出能量b kJ;③放出能量c kJ到1 mol NH3(l)。故可得热化学方程式:
N2(g)+H2(g)NH3(l) ΔH=(a-b-c) kJ·mol-1,扩大计量数后得到A。
答案:A
12.卫星发射时,用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时,铝粉氧化放热引发高氯酸铵分解,其化学方程式可表示为:2NH4ClO4===N2↑+4H2O+Cl2↑+2O2↑,反应放出大量的热,下列有关此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生的大量高温气体推动卫星发射升空
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
解析:2NH4ClO4===N2↑+4H2O+Cl2↑+2O2↑是分解反应,同时产生的大量高温气体推动卫星发射。从能量变化的角度分析,主要是化学能转变为热能和动能。至于高氯酸铵在反应中的作用,由于Cl元素的化合价由 ―→,N元素的化合价从 ―→,O元素的化合价从 ―→,故NH4ClO4在反应中既是氧化剂又是还原剂。
答案:D
11.已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g);ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
解析:该问题可以转化为CO(g)+FeO(s)===Fe(s)+CO2(g);ΔH=?所以应用盖斯定律,若把已知给出的3个热化学方程式按照顺序编号为①、②、③,那么[(①-②)×-③]×即可。
答案:B
10. 下列反应中,其反应放热的是( )
①NaOH溶液中加入盐酸 ②由乙醇制C2H4 ③铝热反应 ④由氯酸钾制O2
A.①② B.②③ C.①③ D.①④
解析:一般来说,化合反应、中和反应、铝热反应为放热反应,分解反应为吸热反应。B、D选项中的物质的制取反应都属于分解反应,都要吸收热量,故只能选C。
答案:C
9.如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2 mL的稀盐酸。下列对烧杯中的实验现象的描述及原因说明中正确的是( )
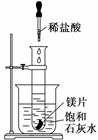
A.烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱和石灰水温度升高,溶
质析出
B.烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶
质析出
C.烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系
D.烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量
解析:金属镁与酸反应放出热量,而Ca(OH)2的溶解度随温度的升高而降低。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com