
题目列表(包括答案和解析)
4. 用Pt电极电解含有0.1 mol Cu2+和0.1 mol X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示。则离子的氧化能力由大到小排列正确的是( )
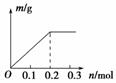
A.Cu2+>X3+>H+ B.H+>X3+>Cu2+
C.X3+>H+>Cu2+ D.Cu2+>H+>X3+
解析:有些同学没有认真分析,就将X3+与Fe3+联系起来,选择答案C。这其实是简单记忆阳离子放电顺序导致思维定势而造成的结果。本题的解题信息在图像中,一通电就有固体析出,且通过0.2 mol电子后,就没有固体析出了,说明是Cu2+放电的结果,X3+不放电。故正确答案为D。
答案:D
3. 用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
解析:电解稀H2SO4,实质上是电解水,硫酸的物质的量不变,但溶液体积减少,浓度增大,故溶液pH减小,A不正确;电解稀NaOH溶液,阳极消耗OH-,阴极消耗H+,实质也是电解水,NaOH溶液浓度增大,故溶液的pH增大,B不正确;电解Na2SO4溶液时,在阳极发生反应:4OH--4e-―→2H2O+O2↑,在阴极发生反应:4H++4e-―→2H2↑,由于两电极通过电量相等,故析出H2与O2的物质的量之比为2∶1,C不正确;电解CuCl2溶液时,阴极反应为Cu2++2e-―→Cu,阳极反应为2Cl--2e-―→Cl2↑,两极通过电量相等时,Cu和Cl2的物质的量之比为1∶1,D正确。
答案:D
2. 用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解 时温度不变且用惰性电极,下列说法不正确的是( )
A.当电池负极消耗m g气体时,电解池阴极有m g气体生成
B.电解池的阳极反应式为:4OH--4e-―→2H2O+O2↑
C.电解后c(Na2SO4)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
解析:氢氧燃料电池的电极反应式分别为:负极:2H2-4e-+4OH-―→4H2O,正极:O2+4e-+2H2O―→4OH-;用惰性电极电解饱和Na2SO4溶液,实质为电解H2O,电极反应式为阳极:4OH--4e-―→O2↑+2H2O,阴极:4H++4e-―→2H2↑。A项,根据转移电子守恒,电池负极消耗H2的质量与电解池阴极生成H2的质量相同;C项,电解后,Na2SO4溶液仍为饱和溶液,温度不变,c(Na2SO4)不变,但由于消耗H2O,溶液中会析出Na2SO4·10H2O晶体;D项,电池中n(KOH)不变,由于生成H2O,c(KOH)减小,电解池中Na2SO4溶液浓度不变,溶液pH不变。
答案:D
1.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式为:Ni2++2e-―→Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
解析:电解精炼铜时,粗铜中比铜活泼的铁、锌等在阳极上首先被氧化变成相应的金属离子进入溶液,比铜不活泼的银、金等金属不能在阳极上被氧化,就以单质的形式沉积在阳极底部形成阳极泥。把这些规律应用到本题中,由于铁、锌等比镍活泼,铜、铂等没有镍活泼,所以铁、锌等要在阳极上被氧化,铜、铂等不会被氧化,而变成阳极泥。故正确答案为D。
答案:D
22.(2009·江苏单科,17)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧
印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是________(填字
母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH=64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g) ΔH=-196.46 kJ·mol-1
H2(g)+O2(g)===H2O(l) ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4的混
合溶液处理,测得不同温度下铜的平均溶解速率(见下表)
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率(×10-3
mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
________________________________________________________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉
淀。制备CuCl的离子方程式是________________。
解析:(1)B会引起大气污染;D会造成土壤、水体重金属污染。
(2)总方程式为Cu+H2O2+2H+===Cu2++2H2O,它可由题目提供的3个方程式得到:
故ΔH=64.39+(-196.46)×+(-285.84)=-319.68 kJ·mol-1
故Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH=-319.68 kJ·mol-1。
答案:(1)BD (2)Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)ΔH=-319.68 kJ·mol-1 (3)H2O2分解速率加快 (4)2Cu2++SO+2Cl-+H2O2CuCl↓+SO+2H+
21.(1)负离子发生器产生的负离子是O,它在大气中存在的时间很短。O2、O3、O三种微粒自身所具有的能量由低到高的顺序是________。
(2)A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放出
的能量;C、D两元素的原子分别失去1个电子形成稳定结构时,D吸收的能量大于C
吸收的能量。若A、B、C、D间分别形成二元素化合物,其中最可能属于离子化合物
的是________(填写时用A、B、C、D表示的化学式)。
(3)下列反应中反应物总能量低于生成物总能量的是________(填写编号)。
A.石灰石受热分解 B.酒精燃烧 C.生石灰溶于水 D.实验室制氧气
E.实验室制乙烯 F.实验室制乙炔 G.用镁条引燃铝、四氧化三铁混合粉
末 H.CuCl2水解
解析:(1)能量越高越不稳定,由此可确定三种微粒的稳定性和能量高低。
(2)由A、B两元素的原子分别得到2个电子形成稳定结构时,A放出的能量大于B放
出的能量。所以A比B的非金属性强。C、D两元素的原子分别失去1个电子形成稳
定结构时,D 吸收的能量大于C吸收的能量,则D比C难失电子,即C的金属性比
D强,故最可能属于离子化合物的是C2A。
答案:(1)O2、O3、O (2)C2A (3)ADEH
20.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量
化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧
化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC______Si;SiCl4______SiO2。
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g)
该反应的反应热ΔH=________kJ·mol-1。
解析:本题主要考查键能的大小与物质性质及反应热之间的关系。(1)SiC与Si皆为原
子晶体,由于Si-C键能大于Si-Si键能,故SiC的熔点比Si高;SiCl4为分子晶体,
SiO2为原子晶体,前者的熔点低于后者。
(2)根据题意所给反应的旧化学键键能之和为:4×360 kJ·mol-1+2×436 kJ·mol-1=2
312 kJ·mol-1,新化学键键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1(每摩硅原子相
当于形成2 mol Si-Si)=2 076 kJ·mol-1,所以反应热为:2 312 kJ·mol-1-2 076
kJ·mol-1=236 kJ·mol-1。
答案:(1)> < (2)+236
19.已知:H+(aq)+OH-(aq)===H2O(l);
ΔH=-57.3 kJ· mol-1,计算下列中和反应里放出的热量
(1)用20 g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出________kJ的热量。
(2)用0.1 mol Ba(OH)2配成的稀溶液跟足量的稀硝酸反应,能放出________kJ的热量。
(3)用1 mol醋酸稀溶液和足量NaOH稀溶液反应,放出的热量__________(大于、小于或等于)57.3 kJ,理由是__________________________________________________________。
(4)1 L 0.1 mol·L-1 NaOH溶液分别与①醋酸溶液、②浓硫酸、③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ)。则它们由大至小的顺序为___________________________。
解析:由于CH3COOH电离要吸收热量,所以CH3COOH(aq)与NaOH(aq)中和放热要少些。浓H2SO4溶解时放出大量热,所以(4)中Q2最大。
答案:(1)28.65 (2)11.46 (3)小于 醋酸电离需要吸热 (4)Q2>Q3>Q1
0.05 (5)S(s)+O2(g)===SO2(g) ΔH1=-296 kJ·mol-1 SO2(g)+O2(g)===SO3(g)
ΔH2=-99 kJ·mol-1 3S(s)+O2(g)===3SO3(g) ΔH=(ΔH1+ΔH2)×3=-1 185 kJ·mol-1
18.(2009·宁夏理综,28)2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如右图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
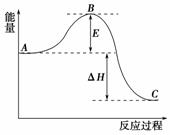
请回答下列问题:
(1)图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________________________________________________________________________。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________________________________________________________。
(2)图中ΔH=________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式________________________________________________________________________;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=________mol·L-1·min-1、v(SO3)=________mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH________(要求计算过程)。
解析:(1)由图像很容易得出,纵坐标表示各种物质的能量。E是反应所必经的一个过渡状态的能量变化,它只影响反应的难易程度,而整个反应过程的反应热只与反应的始终态有关,得出没有影响的结论。加入催化剂改变了反应历程,使活化能降低。
(2)中的ΔH可根据已知1 mol SO2参加反应时放热99 kJ,而图像中表示的是2SO2反应,所以99 kJ要乘以2。
(3)化学方程式根据元素守恒即可写出。
(4)考查速率之比和化学方程式中各物质的计量数成正比。
(5)考查盖斯定律的应用,考查燃烧热的概念必须是1 mol S(s)完全燃烧。
答案:(1)反应物总能量 生成物总能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低 (2)-198 (3)SO2+V2O5===SO3+2VO2 4VO2+O2===2V2O5 (4)0.025
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com