
题目列表(包括答案和解析)
3. 电解NaCl-KCl-AlCl3熔体制铝比电解Al2O3-NaAlF6制铝节省电能约30%,但现在仍用后一种方法制铝,其主要原因是( )
A.AlCl3是分子晶体,其熔体不导电 B.电解AlCl3生成的Cl2会严重污染大气
C.自然界不存在富含AlCl3的矿石 D.生产无水AlCl3较困难,成本又较高
解析:本题主要考查学生处理新信息的能力和对铝工业生产原理的理解。由题意可知NaCl-KCl-AlCl3熔体能导电,A错;工业上可用电解NaCl、MgCl2的方法生产Na、Mg,B显然错误;自然界不存在富含AlCl3的矿石是事实,但不是主要原因,因为AlCl3易水解,所以生产无水AlCl3较困难,成本较高。
答案:D
2.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
解析:电解池的阳极失电子发生氧化反应、阴极得电子发生还原反应。电解熔融的Al2O3制Al时,若用Fe作阳极,会发生Fe-2e-―→Fe2+,Fe2+移动到阴极上发生Fe2++2e-―→Fe,使得到的Al不纯。
答案:A
1.(2009·广东单科,14)可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-―→4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-―→Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
解析:以NaOH为电解液时,不应生成Al(OH)3沉淀,而应生成[Al(OH)4]-;C项,电解液的pH应减小;D项,电子通过外电路从负极流向正极。
答案:A
11.在如图用石墨作电极的电解池中,放入500 mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6 g。请回答下列问题:

(1)B电极发生反应的电极反应式
________________________________________________________________________。
(2)写出电解时反应的离子方程式
________________________________________________________________________。
(3)电解后溶液的pH为________,要使电解后溶液恢复到电解前的状态,则需加入________,其质量为______g。(假设电解前后溶液的体积不变)
(4)请你设计实验确定原溶液中可能含有的酸根离子,要求:提出两种可能的假设,分别写出论证这两种假设的操作步骤,实验现象和实验结论。
①假设一:
________________________________________________________________________;
②假设二:
________________________________________________________________________。
解析:(1)蓝色溶液含Cu2+,A电极有红色固体物质生成,则析出Cu,为阴极;B电极为阳极,析出O2,电极反应式为:4OH--4e-―→2H2O+O2↑。
(2)2Cu2++2H2O2Cu+O2↑+4H+
(3)当溶液中溶质完全电解时,得Cu的物质的量为 =0.025 mol。此时溶液中
c(H+)=0.1 mol/L,pH=1。要使溶液恢复原状,应加入CuO 0.025 mol,即2 g。
(4)因为可溶性盐,电解时得O2,酸根只有常见的SO和NO,应从这两个角度去鉴定。
答案:(1)4OH--4e-―→2H2O+O2↑ (2)2Cu2++2H2O2Cu+O2↑+4H+ (3)1 CuO 2 (4)①假设原溶液中的酸根离子是SO。取电解后的溶液,向其中加入BaCl2溶液,若有白色沉淀生成,则原溶液中所含的酸根离子是SO ②假设原溶液中的酸根离子是NO。取电解后的溶液,向其中加入铜,微热,若铜溶解,并有无色气体生成,且在空气中变为红棕色,则原溶液中所含的阴离子是NO


10.在50 mL 0.2 mol/L CuSO4溶液中插入两个电极通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中浓度变化情况
________________________________________________________________________。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是
________________________________________________________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是
________________________________________________________________________。
解析:(1)(2)小题类似于电镀原理,(3)由Cu2++2e-―→Cu可知2 mol e--1 mol Cu,故阴极析出Cu:0.02 mol×64 g·mol-1=1.28 g。
答案:(1)不变 (2)Zn-2e-―→Zn2+ (3)1.28 Cu2++2e-―→Cu
9. 按下图中装置实验,A、B两烧杯分别盛放200 g 10% NaOH溶液和足量CuSO4溶液。通 电一段时间后,c极上有Cu析出,又测得A杯溶液中NaOH的质量分数为10.23%,试回答:
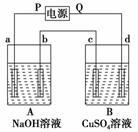
(1)电源的P极为________极。
(2)b极产生气体的体积为________L(标准状况)。
(3)c极上析出沉淀的质量为________g。
(4)d极上所发生的电极反应式为:________________。
解析:B池中c极上有金属析出,说明它为阴极。由此可知,d、b为阳极,a、c为阴极。按照“正接阳,负接阴”的规律,电源的P极为负极。电解NaOH溶液时,a极产生H2,b极产生O2;电解CuSO4溶液时,d极产生O2,其电极反应式为:4OH--4e-―→2H2O+O2↑。
m(NaOH)=200 g×10%=20 g。电解后溶液的质量为:=195.5 g。
被电解的水的质量为:200 g-195.5 g=4.5 g,其物质的量为0.25 mol。
由此可知,b极产生的O2为0.125 mol,即2.8 L。
根据电子守恒得:0.125 mol×4=n(Cu)×2,解得n(Cu)=0.25 mol,即Cu析出16 g。
答案:(1)负 (2)2.8 (3)16 (4)4OH--4e-―→2H2O+O2↑
8. 下图中X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(1)①电源上b为________极(用“正”“负”“阴”或“阳”填空)。
②Z槽中e为______极(同上)。
③连接Y、Z槽线路中,电子流动的方向是d________e(用“→”或“←”填空)。
(2)①写出c极上反应的电极反应式
________________________________________________________________________。
②写出Y槽中总反应化学方程式
________________________________________________________________________。
③写出Z槽中e极上反应的电极反应式
________________________________________________________________________。
(3)①电解2 min后,取出e、f,洗净、烘干、称量,质量差为1.28 g,在通电过程中,电路中通过的电子为______mol。
②若Y槽中溶液体积为500 mL(电解后可视为不变),槽中电解反应的速率v(OH-)=__________。
解析:“附近显红色”是d作为阴极时应有的现象,据此可确定d为阴极,进一步即可解答(1)(2)中问题。
(3)e极因发生反应Cu-2e-―→Cu2+而减轻,f极因发生反应Cu2++2e-―→Cu而增重,每转移2 mol e-两极质量差就增加128 g,即Δm∶Δn(e-)=128 g∶2 mol,Δn(e-)=·Δn==0.02 mol。Y槽中2NaCl+2H2O2NaOH+Cl2↑+H2↑-2e-,当转移0.02 mol e-时产生OH- 0.02 mol,则v(OH-)==0.02 mol/(L·min)。
答案:(1)①负 ②阳 ③← (2)①2Cl--2e-―→Cl2↑ ②2NaCl+2H2O2NaOH+H2↑+Cl2↑ ③Cu-2e-―→Cu2+ (3)①0.02 ②0.02 mol·(L·min)-1
7. 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为三个阶段。下列叙述不正确的是( )
A.阴极自始至终只析出H2 B.阳极先析出Cl2后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
解析:电解质溶液中,n(Na+)∶n(Cl-)∶n(H+)∶n(SO)=3∶3∶2∶1,开始电解产生H2和Cl2,随着产生H2和Cl2的同时,生成OH-,最后是电解水。因而最后溶液的pH>7,阴极只放出H2。三个阶段分别相当于电解HCl(aq)-NaCl(aq)-H2O。
答案:D
6.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液。通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )

A.a为正极,b为负极;NaClO和NaCl B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl D.a为阴极,b为阳极;HClO和NaCl
解析:有关反应2NaCl+2H2O2NaOH+H2↑+Cl2↑,Cl2+2NaOH===NaCl+NaClO+H2O,因阳极生成Cl2,阴极生成NaOH,为使二者充分作用,Cl2应在下端产生,从而推知电源b为正极,a为负极,消毒液主要成分是NaCl、NaClO。
答案:B
5.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol·L-1 B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol D.电解后溶液中c(H+)为0.2 mol·L-1
解析:石墨作电极电解KNO3和Cu(NO3)2的混合溶液,阳极反应式为:4OH--4e-―→2H2O+O2↑,阴极先后发生两个反应:Cu2++2e-―→Cu,2H++2e-―→H2↑。从收集到O2为2.24 L这个事实可推知上述电解过程中共转移0.4 mol电子,而在生成2.24 L H2的过程中转移0.2 mol电子,所以Cu2+共得到0.4 mol-0.2 mol=0.2 mol电子,电解前Cu2+的物质的量和电解得到的Cu的物质的量都为0.1 mol。电解前后分别有以下守恒关系:c(K+)+2c(Cu2+)=c(NO),c(K+)+c(H+)=c(NO),不难算出:电解前c(K+)=0.2 mol·L-1,电解后c(H+)=0.4 mol·L-1。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com