
题目列表(包括答案和解析)
1.下列反应可以设计成原电池的是( )
①CaO+H2O===Ca(OH)2 ②Fe+H2SO4===FeSO4+H2↑ ③2H2O===2H2↑+O2↑
④NaCl+AgNO3===AgCl↓+NaNO3 ⑤Cu+2AgNO3===2Ag+Cu(NO3)2 ⑥Fe+2FeCl3===3FeCl2
A.①②④⑤⑥ B.②③⑤⑥ C.②⑤⑥ D.全部
解析:能设计成原电池的反应要满足两点:反应能自发进行;反应是氧化还原反应。①④是非氧化还原反应,③不能自发进行,②⑤⑥满足以上两点要求。故正确答案为C。
答案:C
21. 蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O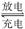 Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是________(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题:
①电解M(NO3)x溶液时某一电极增加了a g M,则金属M的相对原子质量为____________(用含“a、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,阳极产生的气体在标准状况下的体积是________L;
将电解后的溶液加水稀释至1 L,此时溶液的pH=
________________________________________________________________________。
解析:本题主要考查原电池、电解池的基本原理及电解计算。由蓄电池反应式可以看出,电池消耗2 mol H2O时,反应中转移2 mol电子,则消耗0.36 g水时,转移0.02 mol电子。Mx++xe-―→M,金属M的相对原子质量为=50ax。
电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液时,阳极先是Cl-放电:
2Cl--2e-―→Cl2↑,生成0.005 mol Cl2,消耗0.01 mol电子;
然后是水电离产生的OH-放电:4OH--4e-―→2H2O+O2↑,0.01 mol OH-放电,
消耗0.01 mol电子,生成0.002 5 mol O2,所以阳极一共生成0.007 5 mol气体,在标准状况下的体积为0.168 L。0.01 mol Cu2+在阴极放电:Cu2++2e-―→Cu,正好消耗0.02 mol电子,溶液中0.01 mol OH-放电后,产生0.01 mol H+,c(H+)=0.01 mol/L,pH=2。
答案:(1)A (2)①50ax ②0.168 2
20.如下图,通电5 min后,电极5质量增加2.16 g,回答:
(1)电源:a是______极,b是______极;A池电极反应,
电极1:
________________________________________________________________________;
电极2:
________________________________________________________________________。
C池电极反应,电极5:
________________________________________________________________________;
电极6:
________________________________________________________________________。
(2)如果B池中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为____________。
解析:(1)因C池中电极5质量增加,说明电极5为阴极,Ag+得电子;电极6为阳极,又为Cu电极,故Cu失电子。电源a极为负极,b极为正极,A池中电极1为阴极,H+得电子,电极2为阳极,且为惰性电极,故Cl-失去电子。
(2)流经电路的电子的物质的量为:=0.02 mol,若B池中CuSO4足量,其电解反应方程式为:

可知每转移0.02 mol电子,生成O2标准状况下的体积为: mol×22.4 L·mol-1=0.112 L=112 mL,而实得气体224 mL,说明B池中CuSO4不足,电极3上除生成Cu外,还有112 mL H2生成,根据电子得失守恒关系列式如下:
n(Cu)×2+×2=0.02 mol,n(Cu)=0.005 mol,c(CuSO4)==0.025 mol/L。
答案:(1)负 正 2H++2e-―→H2↑ 2Cl--2e-―→Cl2↑ 2Ag++2e-―→2Ag
Cu-2e-―→Cu2+ (2)0.025 mol/L
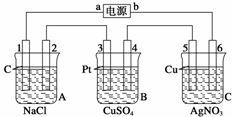
19.如图所示,A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极。
(2)滤纸B上发生的总化学反应方程式为
________________________________________________________________________。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为
________________________________________________________________________,
电极f上发生的反应为
________________________________________________________________________,
槽中盛放的电镀液可以是__________或__________(只要求填两种电解质溶液)。
解析:(1)含酚酞试液的滤纸变红,表示电解时有OH-生成,是由于H2OH++OH-,2H++2e-―→H2↑,生成OH-之故,所以c是B电解池的阴极,d为阳极,则可得出:b是原电池A的负极,a为正极,e是电解槽C的阳极,f为阴极。
(2)2NaCl+2H2O2NaOH+H2↑+
阴极产物
(3)镀件铁作阴极f:Zn2++2e-―→Zn
待镀金属作阳极e:Zn-2e-―→Zn2+, 用含待镀金属离子的溶液作电镀液,可用ZnSO4溶液或ZnCl2溶液。
答案:(1)正 (2)2NaCl+2H2OH2↑+Cl2↑+2NaOH (3)Zn-2e-―→Zn2+Zn2++2e-―→Zn ZnSO4溶液 ZnCl2溶液
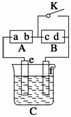
18. 电解原理在化学工业上有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电
极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚
酞试液。
①电解池中X极上的电极反应式为 ,
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
说明:杂质发生的电极反应不必写出。
解析:此题综合考查电解原理及其应用。
由于X极与直流电源的负极相连,所以进行电解时,X为阴极,电解饱和氯化钠溶液阴极
氢离子放电,生成氢气,同时产生氢氧根离子,溶液显碱性,使酚酞变红。阳极氯离子放
电,生成氯气,检验氯气的方法之一是使用湿润的碘化钾淀粉试纸,现象为使试纸变蓝。
电解精炼铜,要用粗铜作阳极,纯铜作阴极。
 答案:(1)①2H++2e-
H2↑放出气体,溶液变红
答案:(1)①2H++2e-
H2↑放出气体,溶液变红
 ②2Cl--2e-
Cl2↑把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
②2Cl--2e-
Cl2↑把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
 (2)①纯铜Cu2++2e-
Cu
(2)①纯铜Cu2++2e-
Cu
 ②粗铜Cu-2e-
Cu2+?
②粗铜Cu-2e-
Cu2+?
17.现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为________________________________________________________________________。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO等杂质离子,使用的试剂有:
a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为____________(填试剂序号)。
(3)如果在容积为10 L的离子交换膜电解槽中,1 min后在阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设溶液体积保持不变)________。
(4)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,则消毒等量的自来水,所需Cl2和ClO2的物质的量之比为________。
解析:由2NaCl+2H2O2NaOH+H2↑+Cl2↑可知,n(NaOH)=2n(Cl2)=2×=1 mol,c(OH-)=0.1 mol·L-1,故溶液的pH=13。
Cl22Cl-,ClO2Cl-,当二者得电子数相等时,消毒能力相当,此时二者物质的量之比为5∶2。
答案:(1)2Cl--2e-―→Cl2↑ (2)bac (3)13 (4)5∶2
16.如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:

(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒。
②乙池中阳极的电极反应式是
________________________________________________________________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式:
________________________________________________________________________。
②甲池中碳极的电极反应式是________,乙池碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,过一段时间后又发现蓝色退去。这是因为过量的Cl2又将生成的I2氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为
________________________________________________________________________。
④若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则反应后溶液的pH=
________。
解析:甲为原电池,乙为电解池。
(1) 若两池中均为CuSO4溶液,则:
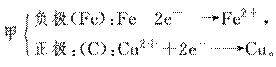
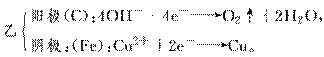
(2)若均为NaCl溶液,则:
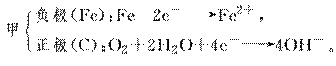
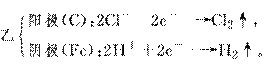
答案:(1)①碳 铁 ②4OH--4e-―→2H2O+O2↑ (2)①2Cl-+2H2OCl2↑+H2↑+2OH- ②2H2O+O2+4e-―→4OH- 氧化反应 ③5Cl2+I2+6H2O===2HIO3+10HCl ④13
1.5×10-3 mol 16.8×10-3 L
c(OH-)==3×10-2 mol/L,
c(H+)===×10-12 mol/L
pH=-lg(×10-12)=12.5。
答案:(1)2H++2e-―→H2↑ 2Cl--2e-―→Cl2↑ 2NaCl+2H2O2NaOH+H2↑+Cl2↑ (2)A B J K(或J K A B) (3)H F G D E C
(4)Cl2+2I-===2Cl-+I2 (5)12.5
15. 请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
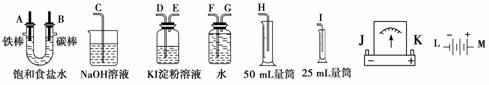
(1)A极发生的电极反应式是
________________________________________________________________________,
B极发生的电极反应式是
________________________________________________________________________。
电解饱和食盐水的化学方程式是
________________________________________________________________________。
(2)电源、电流表与A、B两极的正确连接顺序为:
L→( )→( )→( )→( )→M。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接________。
(4)在实验中,盛有KI淀粉溶液的容器中发生的反应的离子方程式为________________________________________________________________________。
(5)已知饱和食盐水50 mL,某时刻测得H2体积为16.8 mL(标准状况)。此时溶液pH约为__________。(lg 2=0.3,lg 3=0.5,lg 5=0.7)
解析:(1)要达到电解食盐水的目的,则电解池中铁棒必须接上电源的负极而成为阴极,碳棒则接上电源的正极而成为阳极,反之,铁作阳极则Fe2+进入溶液,无法实现电解食盐水的目的。
(2)电源负极接电解池的铁棒、碳棒接电流计“-”端,“+”端接电源正极。
(3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,则有:H←F←G←A B→D→E→C,相应装置的作用:

(5)2NaOH - H2
2 mol 22.4 L
14.某学生欲完成反应2HCl+2Ag===2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是( )
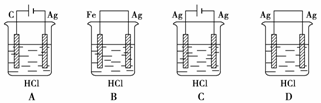
解析:题给反应是一个不能自发进行的氧化还原反应,必须借助电解手段才能使之发生。B、D两装置不是电解池,显然不能使之发生;A装置是电解池,但Ag棒作阴极而不参与反应,其电解池反应不是题给反应,A装置不能使题给反应发生;C装置是电解池,Ag棒作阳极而参与反应,其电解池反应是题给的反应,C装置能使题给的反应发生。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com