
题目列表(包括答案和解析)
11.燃料电池是使气体燃料氧化直接产生电流的装置,燃料电池的研究是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
(1)该电池放电时的化学反应方程式为:
________________________________________________________________________。
(2)该燃料电池的电极反应式为:
正极:13O2+52e-―→26O2-
负极:2C4H10+26O2--52e-―→8CO2+10H2O
则固体电解质中的O2-向________极移动(填“正”或“负”)。
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3 360 mL(标准状况)氧气,阴极析出金属10.4 g,在该含氧酸盐中金属的化合价为________,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是____________g(结果精确至0.01 g)。
解析:(1)2C4H10+13O2===8CO2+10H2O;
(2)根据电极反应式可知氧离子由正极移向负极;
(3)设金属的化合价为x,则根据得失电子守恒关系可得×4=x
所以可得x=3,故此过程中转移的电子的物质的量为0.6 mol,所以消耗的丁烷的质量为1.34 g。
答案:(1)2C4H10+13O2===8CO2+10H2O (2)负 (3)+3 1.34
10.(2009·山东理综,29)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是________________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
解析:(1)原电池的负极是发生氧化反应的一极:Zn―→Zn2++2e-;电池工作时,电子是从负极流向正极
(2)Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀。
(3)电解池的阴极是发生还原反应的一极:2H++2e-―→H2↑;每生成1 mol MnO2需转移
2 mol电子,故每通过2 mol电子,理论上生成1 mol MnO2,质量为87 g。
答案:(1)Zn(或锌) 正极 (2)锌与还原出的铜构成铜锌原电池而加快锌的腐蚀 b
(3)2H++2e-―→H2↑ 87
9.
新型高能钠硫电池以熔融的钠、硫为电极,以导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS Na2Sx。
Na2Sx。
(1)放电时Na发生________反应,S作________极。
(2)充电时Na所在电极与直流电源的________极相连。
(3)放电时负极反应为
________________________________________________________________________;
充电时阳极反应为
________________________________________________________________________。
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生33.6 L(标准状况)气体时,消耗金属Na的质量为______。
解析:该题考查化学“两池”(原电池、电解池)的原理及应用,以新的科技成果即新型高能钠硫电池为背景,要求考生学会应用原电池的原理解释新问题、新现象。主要考查对知识的应用能力、计算能力、推理能力等。
解答本题要仔细审题,寻找突破口--“电池放电时为原电池”,根据原电池的知识,失电子,发生氧化反应的电极是负极;得电子,发生还原反应的电极是正极。(1)Na作负极,S作正极。负极反应为Na-e-―→Na+;(2)“充电时为电解池”,根据电解的知识,阳极失电子,发生氧化反应;阴极得电子,发生还原反应。因此Na所在的电极是阴极,与直流电源的负极相连,S所在的电极是阳极,与直流电源的正极相连,阳极反应式为
S-2e-―→xS。(4)电解饱和NaCl溶液阳极产生的气体是Cl2,由2Cl--2e-―→Cl2,又2Na-2e-―→2Na+,可列式求得Na的质量为69克。
答案:(1)氧化 正 (2)负 (3)Na-e-―→Na+ S-2e-―→xS (4)69 g
8. 由A、B、C、D四种金属按下表中装置进行实验。
|
装置 |
 |
 |
 |
|
现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是
________________________________________________________________________。
(2)装置乙中正极的电极反应式是
________________________________________________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是
________________________________________________________________________。
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,活泼性A>B;乙中C极增重,即析出Cu,则B为负极,活泼性B>C;丙中A上有气体即H2产生,则A为正极,活泼性D>A,随着H+的消耗,pH变大。
答案:(1)A-2e-―→A2+ (2)Cu2++2e-―→Cu (3)变大 (4)D>A>B>C
7.(2009·宣武区调考题)蓄电池在放电时起原电池的作用,在充电时起电解池的作用,下式是爱迪生蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O放电充电Fe(OH)2+Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是( )
A.放电时,Fe作负极,发生氧化反应
B.放电时,NiO2作正极,发生还原反应
C.充电时,阴极上Fe(OH)2放电,发生氧化反应
D.蓄电池的电极应浸入碱性电解质溶液中
解析:放电时为原电池原理,Fe作负极发生氧化反应,有化合价升高过程,NiO2在正极发生还原反应,有化合价降低的变化。A、B项正确;充电时阴极发生还原反应,C项错误;此蓄电池中有Fe(OH)2、Ni(OH)2等能溶于酸的弱碱,所以电解质溶液不能是酸,应是碱性溶液。
答案:C
6.为研究金属腐蚀的条件和速度,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在如图所示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间,下列对实验结束时现象的描述不正确的是( )

A.装置甲左侧的液面一定会下降 B.装置乙中的铁钉腐蚀最快
C.装置丙中的铁钉几乎没被腐蚀 D.装置甲中的铁丝和装置乙中的铜丝都会被腐蚀
解析:甲、乙中盐酸有挥发性,甲中发生化学腐蚀,产生H2使左侧液面下降;乙中发生电化学腐蚀,产生H2比甲中快,铁钉腐蚀最快;丙中浓H2SO4有吸水性且H2SO4无挥发性,铁钉几乎不被腐蚀;乙中Cu是原电池的正极,不发生腐蚀。
答案:D
5. 某原电池的电池反应为Fe+2Fe3+―→3Fe2+,与此电池反应相符的原电池是( )
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.银片、石墨、Fe(NO3)2溶液组成的原电池
解析:由电池反应知:Fe失电子应作原电池负极,而正极反应为Fe3++e-―→Fe2+,要求电解液必为含Fe3+的盐溶液,且电极材料相对Fe较不活泼,从而得到答案。此题考查了学生的逆向思维。
答案:AB
4.有关下图装置中的叙述正确的是( )
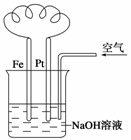
A.这是电解NaOH溶液的装置
B.溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
C.Fe为正极,电极反应为:Fe-2e-+2OH-―→Fe(OH)2
D.NaOH溶液的碱性逐渐减弱
解析:这是一个原电池装置,也是一个吸氧腐蚀装置。电极反应的书写应与电解质溶液的性质相联系。电解质pH的变化应与电极反应相联系。
答案:B
3.下列关于钢铁腐蚀的叙述正确的是( )
A.吸氧腐蚀时正极放出氧气 B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率 D.析氢腐蚀比吸氧腐蚀普遍

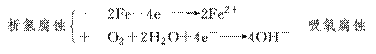
答案:B
2.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
A.在熔融电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2―→8CO2+10H2O
C.通入空气的一极是正极,电极反应为:O2+4e-―→2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-―→4CO2↑+5H2O
解析:由原电池原理知负极失去的电子经导线转移到正极,所以正极上富集电子,根据电性关系,O2-不可能移向正极,A错;原电池反应就是一个氧化还原反应,只是氧化反应和还原反应分别在两极进行,由丁烷的燃烧反应知,该电池的总反应为:2C4H10+13O2===8CO2+10H2O,且丁烷失电子,O2得电子,故选B、C。
答案:BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com