
题目列表(包括答案和解析)
4.丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目是( )
A.2种 B.4种 C.6种 D.3种
解析:判断本题,可采用换元法,就是将氯原子换成氢原子,将氢原子换成氯原子。从题意可知,二氯代物有4种同分异构体,则六氯代物也有4种同分异构体。
答案:B
3.“神七”使用偏二甲肼和四氧化二氮作火箭燃料。偏二甲肼的化学式为C2H8N2,则C2H8N2不含碳碳键的同分异构体有( )
A.2种 B.3种 C.5种 D.6种
解析:本题考查根据分子式书写同分异构体的知识。根据化学键连接方式,C2H8N2可能有6种结构:CH3NH-NHCH3,CH3CH2NHNH2,(CH3)2N-NH2,NH2CH2CH2NH2,CH3CH(NH2)2,CH3NHCH2NH2,其中不含碳碳键的同分异构体只有3种。
答案:B
2. 甲烷在不同条件下有两种热分解反应: ①CH4(g)C(s)+2H2(g);②2CH4(g)电弧1 500℃C2H2(g)+3H2(g)。现将两份标准状况下等体积的甲烷分别通入两个容积可变的密闭容器中,按①式和②式热解,待完全反应后,恢复至标准状况,则两容器中气体体积关系正确的是( )
A.①和②相等 B.①小于② C.①大于② D.无法判断
解析:本题是从气体体积变化的角度来考查甲烷的热解反应。反应①生成物C为固体,所以反应后的气体体积为反应前的2倍,反应②的生成物全为气体,反应后的气体体积也为反应前的2倍,也就是两个反应前后的气体体积比均为1∶2,等体积的甲烷发生反应①和反应②后得到的气体体积相等。
答案:A
1.(2008·上海综合能力测试,12)吸烟对人体危害极大,香烟燃烧产生大量污染物。下表为某品牌香烟烟雾中各物质的含量,香烟烟雾中( )
|
物质 |
CO |
CO2 |
C2H6 |
NOx |
焦油 |
尼古丁 |
甲醛 |
苯 |
|
含量 (mg/支) |
17 |
60 |
0.6 |
0.6 |
35 |
2.5 |
0.05 |
0.1 |
A.只有尼古丁有毒 B.有害物质的含量超过了40%
C.含有的烃类在常温下均为气态 D.有气味的是C2H6、NOx、尼古丁
解析:根据题干信息条件及相关化学知识可知:香烟烟雾中的CO、NOx、焦油、尼古丁、甲醛、苯都属于有毒有害物质。其有害物质的总含量也超过了40%,因此A是错误的,B是正确的。烟雾中C2H6、苯都是烃类但苯常温下为液态,其中除了CO、CO2、C2H6外,其他物质均有气味,故C、D错误。
答案:B
19. 化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米、淀粉等发酵制得。A的钙盐是人们喜爱的补钙剂之一,A在某种催化剂存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下反应。

试写出:
(1)化合物A、B、D的结构简式:
A________;B________;D________。
(2)化学方程式:
A―→E_______________________________________________________________________;
A―→F_______________________________________________________________________。
(3)反应类型:A―→E________;A―→F________。
解析:本题是框图型有机推断题,其突破口是化合物A。A的确定既可以从题干中的隐含信息得到,也可以从框图中的反应关系得到。
从题干所给信息确定A:根据“A最早发现于酸牛奶中”及“A的钙盐是人们喜爱的补钙剂之一”,可判断A为乳酸CH3CHOHCOOH,而A被氧化可得CCH3COOHO,不能发生银镜反应,这就进一步证明了A是乳酸。
从所给框图中的反应关系确定A:A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基。A催化氧化的产物不能发生银镜反应,说明羟基不在碳链的端点上。
答案:(1)

(2)  ;
;
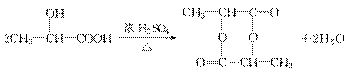
(3)消去反应 酯化反应
指点迷津:(1)要熟悉各类有机物的特征反应,特别要注意题干里给予的各种信息。
(2)要尝试找出推断链条中的薄弱环节,一旦突破口找到,整个题目就“不攻自破”。突破口可以通过分子式、反应条件、反应现象、反应生成物的特性来判断。
(3)要掌握同一分子式的不同分子(同分异构体)间的不同反应,这也是解决问题的关键。
18. 已知乙醇可以和氯化钙反应,生成微溶于水的CaCl2·6C2H5OH。有关试剂的部分数据如下:
|
物 质 |
熔点(℃) |
沸点(℃) |
密度(g/cm3) |
|
乙 醇 |
-117.0 |
78.0 |
0.79 |
|
乙 酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
|
浓硫酸(98%) |
- |
338.0 |
1.84 |
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5-10分钟

③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层。
④分离出乙酸乙酯层并洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:____________________,写出制取乙酸乙酯的化学方程式:________________________。
(2)上述实验中饱和碳酸钠溶液的作用是:________(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:________________。
(4)指出步骤③所观察到的现象:________________;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去________(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为________(填字母)。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),试分析与上图的装置相比,此装置的主要优点。

解析:本题对乙酸乙酯的制备及改进创新进行了细致全面的考查。第(1)问看似容易,实际上隐藏着定量问题:“加热时,试管内液体的体积不超过试管容积的1/3”。(4)涉及到乙酸乙酯的精制:在用饱和碳酸钠溶液除去乙酸和乙醇的基础上。用饱和食盐水萃取碳酸钠,用氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;不能选择P2O5、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解。第(5)问是针对教材实验装置的不足进行的改进创新。
答案:(1)在一个30
mL大试管中注入4 mL乙醇,再分别缓缓加入4
mL乙酸、1 mL浓硫酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10
mL);CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O (2)BC (3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应
CH3COOCH2CH3+H2O (2)BC (3)反应物中乙醇、乙酸的沸点较低,若用大火加热,大量反应物随产物蒸发而损失原料,温度过高还可能发生其他副反应
(4)在浅红色碳酸钠溶液层上方有无色液体出现,闻到香味,振荡后碳酸钠溶液层红色变浅;碳酸钠、乙醇 B (5)a.增加了温度计,有利于控制发生装置中反应液的温度;b.增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;c.增加了冷凝装置,有利于收集产物。
17.科学家们发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学和医学奖。
请回答下列问题
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________,D是双原子分子,相对分子质量是30,则D的分子式是________。
(2)油脂A经下列途径可得到M。图中②的提示:C2H5OH+HO-NO2C2H5O-NO2+H2O反应①的化学方程式是______________,反应②的化学方程式是______________。
A
解析:(1)C原子个数为:≈3;H原子个数为:≈5;N原子个数为:≈3;O原子个数为:=9,所以分子式为C3H5O9N3。D为NO,相对分子质量为30。
(2)油脂就是高级脂肪酸甘油酯,可以水解得到高级脂肪酸和甘油,甘油和HNO3按照给出的提示发生酯化反应。有关反应的化学方程式为:


答案:(1)

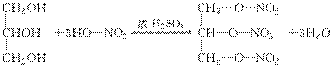
16.下面是一个四肽,它可看作是4个氨基酸缩合掉3分子水而得,
 ,式中的R,R′、R″、R?可能是相同的或不同的烃基或有取代基的烃基。-NH-CO-称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
,式中的R,R′、R″、R?可能是相同的或不同的烃基或有取代基的烃基。-NH-CO-称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
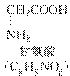



问:(1)这个“多肽”是________肽;
(2)该多肽水解后,有________个谷氨酸;
(3)该多肽水解后,有________个苯丙氨酸。
解析:观察形成该“多肽”的四种氨基酸的结构特点,每个氨基酸的结构中只有一个氨基,即只含有一个氮原子,在形成肽时,氮原子都进入肽中,所以该“多肽”分子式中有几个氮原子即为几肽。因此这个“多肽”为十肽。
根据氨基酸在形成多肽时原子数目的变化规律,利用解方程组法解决。设该十肽中含有甘氨酸、丙氨酸、苯丙氨酸、谷氨酸的个数分别为a、b、c、d,根据题意列方程组得
解得,所以该十肽水解后有4个谷氨酸,3个苯丙氨酸。
答案:(1)十 (2)4 (3)3
15.经测定乙醇的化学式是C2H6O,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是下列二种之一。
(Ⅰ) (Ⅱ)
(Ⅱ)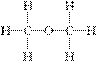
为测定其结构,应利用物质的特殊性进行定性、定量实验,现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用右图给定的装置进行实验,确定乙醇的结构。
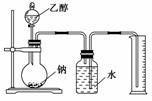
(1)学生甲得到一组实验数据:
|
乙醇的物质的量(mol) |
氢气的体积(L) |
|
0.10 |
1.12(标准状况) |
根据以上数据推断乙醇的结构应为________(用Ⅰ、Ⅱ表示),理由为
________________________________________________________________________。
(2)同学乙分别准确称量4.60 g乙醇进行多次实验,结果发现以排在量筒内的水的体积作为生成的H2体积换算成标准状况后都小于1.12 L,如果忽略量筒本身及乙读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?________(填“正确”或“不正确”)如果你认为正确,请说明理由;如果你认为不正确,那么产生这种情况的原因应该是什么?
________________________________________________________________________
________________________________________________________________________。
(3)同学丙认为实验成功的关键有:①装置气密性要良好,②实验开始前准确确定乙醇的量,③钠足量,④广口瓶内水必须充满,⑤氢气体积的测算方法正确、数值准确。其中正确的有________(填序号)。
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需知道的数据是________________________________________________________________________。
(5)实验后,四名同学从乙醇的可能结构分析入手对乙醇和钠的量的关系进行了讨论,如果乙醇的物质的量为n mol,那么对钠的物质的量的取值要求必须是________。
解析:本题考查学生实验设计能力,测量气体体积的方法及分析误差的能力,是一个探究性实验。(1)实验数据表明:1 mol C2H6O与足量的钠反应,产生11.2 L H2,即0.5 mol H2,也就是1 mol H。说明1个C2H6O分子中只有1个氢原子被Na置换,故结构式为Ⅰ而不是Ⅱ。(2)乙同学认为样品中含少量水是错误的,因为2Na+2H2O===2NaOH+H2↑,等质量的水产生的氢气比等质量的乙醇多,应大于1.12 L。真正的原因是广口瓶与量筒之间玻璃导管中水柱的体积没计算在内。(3)同学丙关于实验成功的关键的五点中,只有④是不必要的,因为反应的烧瓶和导管中都存在空气,并不影响实验的准确性。(4)同学丁不想称量乙醇的质量,则只有量取其体积,因此必须知道乙醇的密度。(5)本实验目的是推测乙醇分子的结构,乙醇必须作用完,若乙醇为n mol,由化学反应方程式知:C2H5OH+Na―→C2H5ONa+H2↑,金属钠的物质的量必须大于n mol。
答案:(1)Ⅰ 得到H2的体积说明乙醇分子中有一个H与其他五个H不同,从而确定乙醇分子的结构为Ⅰ (2)不正确 广口瓶与量筒之间玻璃导管中水柱的体积没计算在内 (3)①②③⑤ (4)所给乙醇样品的密度 (5)大于n mol
14. (2008·上海化学,3)植物及其废弃物可制成乙醇燃料,下列关于乙醇燃料的说法错误的是( )
A.它是一种再生能源 B.乙醇易燃烧,污染小
C.乙醇只能在实验室内作燃料 D.粮食作物是制乙醇的重要原料
解析:乙醇是可再生能源,A正确;乙醇易燃烧,产生污染小,B正确;乙醇除了在实验室内作燃料外,可以用于乙醇汽油,C错;乙醇可由含淀粉、纤维素丰富的粮食作物水解制取,D正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com