
题目列表(包括答案和解析)
4.有机物菲的结构式如图所示: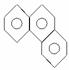 ,其一氯代物的数目为( )
,其一氯代物的数目为( )
A.3种 B.4种 C.5种 D.6种
解析:菲的化学式为C14H10,其结构中共有10个氢原子可被取代,但该结构属于对称结构。(如图所示): 故一氯取代物有5种。
故一氯取代物有5种。
答案:C
3. 下列说法不正确的是( )
A.天然油脂一般都是纯净物
B.油脂是不溶于水、比水轻的酯类物质
C.油脂的硬化反应与碳碳双键官能团有关
D.油脂的皂化反应是酯基在碱性条件下的水解反应
解析:天然油脂都属于混合物,因此A选项不正确。油脂不溶于水,密度比水小,属于酯类,因此B选项正确。油脂的硬化反应是烃基中碳碳双键与氢气在催化剂加热加压条件下发生的加成反应,因此C选项正确。油脂的皂化是酯基在碱性条件下的水解生成高级脂肪酸钠和甘油的反应,因此D选项正确。
答案:A
2.下列对合成材料的认识不正确的是( )
A.有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而 制得的
B. 的单体是
的单体是
C.聚乙烯( )是由乙烯加聚生成的纯净物
)是由乙烯加聚生成的纯净物
D.高分子材料可分为天然高分子材料和合成高分子材料两大类
解析:有机高分子化合物分天然高分子化合物和合成高分子化合物两类,合成高分子化合物主要由加聚、缩聚两类反应制备,加聚和缩聚是聚合反应的两种类型。对于高分子化合物来说,尽管相对分子质量很大,却没有一个准确的相对分子质量,只有一个范围,但它们的结构均是由若干链节组成的。
答案:C
1. 关于生物体内氨基酸的叙述错误的是( )
关于生物体内氨基酸的叙述错误的是( )
A.构成天然蛋白质的氨基酸分子的结构通式是
B.人体内氨基酸的分解代谢终产物是水、二氧化碳和尿素
C.人体内所有氨基酸均可以互相转化
D.两个氨基酸通过脱水缩合形成二肽
解析:生物体蛋白质的基本组成单位是氨基酸,氨基酸的结构特点是有一个氨基和一个羧基同时连在同一个碳原子上,选项A氨基酸的结构通式正确。人体内氨基酸的代谢终产物是水、二氧化碳和尿素。两个氨基酸通过脱水缩合以后形成的化合物叫做二肽。在人体内能够通过转氨基作用形成的只是12种非必需氨基酸,由于人体无法产生某些中间产物,所以有8种氨基酸必需从食物中获得,故称之为必需氨基酸。所以“人体内所有氨基酸均可以互相转化”这一说法是错误的。
答案:C
20.汽车尾气污染已成为一重大公害。汽车内燃机内,汽油汽化后与空气按一定比例混合进入气缸,引擎用电火花引燃,产生压力推动活塞。燃烧时产生有害气体通过尾气排出污染大气。假设汽油成分全部为辛烷,试定量讨论分析如下问题:
(1)设辛烷气体与空气的体积比(相同条件下)为a,要使辛烷完全燃烧a的最大值为________。
(2)若辛烷与空气的体积比>a时,尾气中会产生污染大气的有毒气体主要是__________,当燃烧1 mol辛烷该污染气体含x mol时,反应的化学方程式是________________________________________________________________________。
(3)若辛烷与空气的体积比<a时,尾气中仍能产生污染大气的有毒气体主要是__________,产生该气体的化学方程式是_____________________________________。
解析:(1)a值的推算依据:辛烷完全燃烧2C8H18+25O216CO2+18H2O,则=×=0.016。
(2)辛烷与空气的体积比>a时,氧气不足,会产生CO气体。辛烷与空气体积比<a时,氧气过量,会产生NO、NO2。
答案:(1)0.016(或) (2)CO C8H18+(25-x)O2xCO+(8-x)CO2+9H2O
(3)NOx(或NO、NO2) N2+O22NO,2NO+O2===2NO2
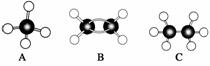
19. 现有A、B、C三种烃,其球棍模型下图:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
解析:据球棍模型可知A为CH4,B为C2H4,C为C2H6。
(1)等质量的烃CxHy完全燃烧时,氢元素的质量分数越大,耗氧量越大,CH4、C2H4、C2H6中的依次为、、,故CH4耗O2最多;
(2)等物质的量的烃CxHy完全燃烧时,(x+)的值越大,耗氧量越大,CH4、C2H4、C2H6的x+依次为1+=2、2+=3、2+=3.5,故C2H6耗O2最多;
(3)n(CO2)=n(C)=×1、×2、×2,×2最大,故C2H4生成的CO2最多;
n(H2O)=n(H)=××4、××4、××6,××4最大,故CH4生成的H2O最多。
(4)温度≥100℃条件下,当烃分子中含有4个氢原子时,该烃完全燃烧前后气体体积不变,y=4的为CH4、C2H4,故答案为CH4、C2H4。
答案:(1)A (2)C (3)B A (4)A、B
18.人们对烷烃分子空间结构的研究发现,某一系列烷烃分子中只有一种一卤代物。如:

这一系列烷烃具有一定的规律性。当一种分子的氢原子全部被甲基取代后,它的一卤代物异构体的数目不变。试回答:
(1)这一系列烷烃的化学式的通式是
________________________________________________________________________。
(2)这一系列烷烃中第6种烷烃的化学式是
________________________________________________________________________。
(3)上述一系列烷烃中,其中含碳量最高的烷烃中碳元素的质量分数是________。
解析:(1)甲烷、新戊烷、十七烷分子中氢原子个数为等比数列:4,12,36,…公比q=3,根据等比数列通项公式an=aqn-1,可知此烷烃的氢原子通项公式为4×3n-1,进而可知,该烷烃的碳原子通项公式为=2×3n-1-1,所以该系列烷烃的化学式的通式为C2×3n-1-1H4×3n-1。
(2)根据(1)的通式,将n=6代入,求出第6种烷烃的化学式为C485H972。
(3)碳的质量分数为:w(C)==
取极限得: (C)=,所以w(C)=×100%=85.7%。
答案:(1)C2×3n-1-1H4×3n-1(n≥1,且为正整数) (2)C485H972 (3)85.7%
17.烷烃分子中的基团:-CH3、-CH2-、 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,则烷烃(除甲烷外)中存在的关系有:(用以上符号回答)
(1)烷烃分子中氢原子数n0与n1,n2,n3,n4之间的关系式是:n0=________或n0=________。
(2)烷烃分子中四种碳原子之间的关系为:n1=________。
(3)若某烷烃分子中n2=n3=n4=1,则满足此等式的分子结构可能有________种(填数字)。
解析:烷烃的通式为CnH2n+2,则n0=2(n1+n2+n3+n4)+2=3n1+2n2+n3,故n3+2n4+2=n1。
当n2=n3=n4=1时,n1=5,则该烷烃的分子式为C8H18,满足n2=n3=n4=1的结构可能有3种:(CH3)3CCH(CH3)CH2CH3、(CH3)3CCH2CH(CH3)2、(CH3)2CHC(CH3)2CH2CH3。
答案:(1)3n1+2n2+n3 2(n1+n2+n3+n4)+2
(2)n3+2n4+2 (3)3
16.下列三种化合物A、B、C中所含有的元素不多于三种,且分子内所含X、Y元素的质量分数及化合物的部分性质列于下表:
|
化合物 |
A |
B |
C |
|
w(X) |
0.077
9 |
0.237
6 |
0.75 |
|
w(Y) |
0.922
1 |
0.703 |
0 |
|
常压下T℃时的密度(g/cm3) |
1.594
7(20℃) |
2.254
5×10-3(0℃) |
0.668×10-3(20℃) |
|
沸点/℃ |
76.8 |
-23.7 |
-161.49 |
|
熔点/℃ |
-22.95 |
-97 |
-182.48 |
原子质量均大于10,且Y的相对原子质量比X的相对原子质量的两倍还要大。根据上述有关信息回答下列问题:
(1)化合物B的相对分子质量为________。
(2)确定化合物C的推理过程为:________。
(3)A与B的化学式为A________,B________。
解析:(1)分析表格数据可以发现B、C常温下均为气态,已知B标准状况下的密度,根据M=22.4 L/mol×2.254 5×10-3 g/cm3×103=50.5 g/mol,即得其相对分子质量;B中肯定含有另外一种元素,该元素在B中占有总质量为50.5×(1-0.703-0.237 6)=3,原子量小于3的只有氢,说明B中含有H。
(2)C中Y含量为0,X含量为75%,即C中一定含有H,且含量为25%。设C的分子式为XHn,根据=25%,Mr(X)=3n,讨论n=1、2、3、4,可得只有n=4合理。X相对原子质量为12,则X为碳,C的分子式为CH4。
(3)根据B中H总质量为3,说明B中含有3个氢原子,B的分子式设为CaH3Yb,则12a+3+bMr(Y)=50.5,由于B中X含量为0.237 6,故a=1,则bMr(Y)=35.5,只有b=1合理,Y的相对原子质量为35.5,即氯元素。根据A的含量只有X、Y两种元素可以确定A为CCl4。
答案:(1)50.5 (2)见解析(2) (3)CCl4 CH3Cl
15.(1)请结合碳元素的原子结构特点及成键特征分析,含n个碳原子的烷烃中,碳原子间共用电子对数为________,结合的氢原子数为________。
(2)烃分子中失去一个或几个氢原子后剩余的部分叫烃基,如:
CH4―→ -CH3+·H

试写出以下粒子的电子式,并分析其存在情况。
NH________,H2O________,-CH3________,-CH2-________,-CH2-CH3________
解析:(1)烷烃中每2个碳原子间形成一个共用电子对,n个碳原子间形成(n-1)个共用电子对,共用的电子为2(n-1)个,碳原子有4个价电子,除碳原子间用去2(n-1)个电子外,其余的均和氢原子形成C-H键,即结合4n-2(n-1)=2n+2个氢原子。
(2) 
NH为带一个单位正电荷的铵根离子,能独立存在。H2O为电中性的分子,能独立存在。
-CH3、-CH2-、-CH2-CH3、-C3H7均为电中性的粒子,不能独立存在。
答案:(1)n-1 2n+2
(2) 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com