
题目列表(包括答案和解析)
4. 在25℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和
b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积( )
A.a=b=10 mL B.a=b>10 mL C.a<b D.a>b
解析:在溶液中,HCl电离是不可逆的,而CH3COOH的电离是可逆的,存在电离平衡,在加水稀释的过程中,HCl溶液里c(H+)的主要变化只有一个,即减小;CH3COOH溶液里c(H+)的主要变化有两个,即减小和增大。若a=b,稀释后的CH3COOH溶液pH<5,若使CH3COOH溶液pH=5,就必须进一步加水稀释,即a>b。
答案:D
0.017 mol·L-1;当加入100 mL 0.020 mol·L-1的 Na2SO4溶液后,c(SO)=0.018 5 mol·L-1,
c(Ag+)=0.017 mol·L-1(此时Q<Ksp)。由计算可知选B。
答案:B
3.已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是( )
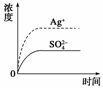
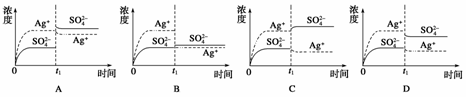
解析:当Ag2SO4刚好溶解为100 mL的饱和溶液时,c(Ag+)=0.034 mol·L-1,c(SO)=
2.下列说法正确的是( )
A.难溶电解质的溶度积Ksp越小,则它的溶解度越小
B.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示
C.溶度积常数Ksp与温度有关,温度越高,溶度积越大
D.升高温度,某沉淀溶解平衡逆向移动,说明它的溶解度是减小的,Ksp也变小
解析:本题易错选A或B。同类型的难溶电解质Ksp越小,溶解度越小,不同类型的电解质无法由溶度积比较溶解度大小,如CuS与Ag2S,故A错;B选项错在“任何难溶物”,而不是“难溶电解质”。
答案:D
1.8×10-10 mol2·L-2=Ksp,故有AgCl沉淀生成。
答案:A
1.在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL 0.01 mol·L-1 的AgNO3溶液,下列说法正确的是(已知AgCl的Ksp=1.8×10-10 mol2·L-2)( )
A.有AgCl沉淀析出 B.无AgCl沉淀析出
C.无法确定 D.有沉淀但不是AgCl
解析:Qc=c(Cl-)·c(Ag+)=0.01 mol·L-1××0.01/101 mol·L-1≈10-6 mol2·L-2>
21.25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”)________,其理由是________________________________________________________________________。
(2)a值可否等于5(填“可”或“否”)________,其理由是________________________________________________________________________。
(3)a的取值范围是________。
解析:(1)若a=3,由a=0.5b,可知b=6,由题设pH=b的是一元强碱,与题设矛盾,所以应答“否”。
(2)若a=5,则b=10,c(OH-)b=10-4 mol/L,中和时,应该有Vac(H+)a=Vbc(OH-)b
即===10>1,与题设Va<Vb不符,所以也应答“否”。
(3)<1,可得式====10a+b-14<1,由a=0.5b和(a+b-14)<0,3a<14,a<,又pHb=b=2a>7[由(1)小题提示强碱溶液的条件],a>,因此a的取值范围是<a<或(4.67>a>3.50)。
答案:(1)否 若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
(2)否 若a=5,c(H+)a=10-5 mol·L-1,则b=10,c(OH-)b=10-4 mol/L,=>1,不符合题意,故a≠5。
(3)<a<(或4.67>a>3.50)
20. (1)室温时1 L 0.01 mol·L-1的硫酸氢钠溶液的pH为____________,在其中滴入等体积的0.01 mol·L-1的Ba(OH)2溶液后,加水稀释到10 L,所发生反应的离子方程式为________________________________________________________________________,
pH为________。
(2)某温度(t℃)时,水的离子积为KW=1×10-13 mol2·L-2,则该温度(填“大于”、“小于”或“等于”)________25℃,其理由是________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是________________。
②若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是________。
解析:(1)主要考查pH的计算,在酸中用c(H+)计算,在碱中用c(OH-)计算,0.01 mol·L-1的硫酸氢钠溶液中c(H+)=0.01 mol·L-1,所以pH=2;酸碱混合,首先判断过量,此题中碱过量,混合后溶液显碱性,应用c(OH-)计算,c(OH-)=
=10-3 mol·L-1,求出c(H+)= mol·L-1=10-11 mol·L-1,pH=11;假设NaHSO4、Ba(OH)2物质的量分别为1 mol,OH-过量以NaHSO4为主进行书写。
(2)KW随温度升高而增大,本题温度为高于25℃。
①H2SO4中[H+]=0.1 mol/L,则NaOH溶液中[OH-]==0.01 mol/L,0.01 mol/L×a L=0.1 mol/L×b L,a∶b=10∶1,离子浓度关系:[Na+]>[SO]>[H+]=[OH-]
②若pH=2,则[H+]混==0.01 mol/L,a∶b=9∶2
离子浓度关系:此时,假如原来NaOH溶液为9 L、H2SO4溶液则为2 L
n(Na+)=0.01 mol/L×9 L=0.09 mol
剩余n(H+)=0.01 mol/L×(9 L+2 L)=0.11 mol
n(SO)=×2 L=0.1 mol,所以:[H+]>[SO]>[Na+]>[OH-]
答案:(1)2 Ba2++OH-+H++SO===BaSO4↓+H2O 11
(2)大于 KW随温度升高而变化 ①10∶1 [Na+]>[SO]>[H+]=[OH-]
②9∶2 [H+]>[SO]>[Na+]>[OH-]
19.(1)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=________。
解析:(1)0.01 mol·L-1 NaOH溶液的pH=11,则KW=c(H+)·c(OH-)=1×10-11 mol/L×0.01 mol/L=1×10-13 mol2·L-2。(2)pH=a的NaOH溶液中,c(OH-)=KW/c(H+)=10-13+a mol·L-1,pH=b的H2SO4中,c(H+)=10-b mol·L-1,两者混合后;①若呈中性,则10-13+a·Va=10-b·Vb,将a=12,b=2代入,得Va∶Vb=1∶10。②若pH=10,则呈碱性,c(OH-)混==10-3 mol·L-1,而c(OH-)混=,将a=12,b=2代入,得Va∶Vb=1∶9。
答案:(1)1×10-13 (2)①1∶10 ②1∶9
18. 常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________mol/L;c(H+)-c(MOH)=________mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度______MCl的水解程度。(填“>”、“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”、“<7”或“无法确定”)
解析:(1)①由混合溶液pH=6知反应生成的盐发生了水解,故促进了水的电离,而酸抑制了水的电离。②c(H+)=10-6 mol/L,c(OH-)=10-8 mol/L,由电荷守恒关系可得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L。
物料守恒:c(Cl-)=c(M+)+c(MOH),则c(H+)-c(MOH)=c(H+)-[c(Cl-)-c(M+)]=10-6 mol/L-9.9×10-7 mol/L=1.0×10-8 mol/L。
(2)反应所得溶液为等物质的量浓度的MOH和MCl的混合液,只有MCl的水解程度大于MOH的电离程度时,才能使溶液pH<7。
(3)酸中已电离的c(H+)和碱溶液中c(OH-)相等,等体积混合后pH≠7,只可能是弱酸过量。
答案:(1)①> ②9.9×10-7 1.0×10-8 (2)< (3)<7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com