
题目列表(包括答案和解析)
2. 在pH=13的无色溶液中,可以大量共存的一组离子是( )
A. NH、NO、K+、SO B.CO、NO、HCO、Na+
C.Na+、ClO-、[Al(OH)4]-、NO D.CrO、K+、Na+、SO
解析:pH=13,溶液中的c(OH-)=0.1 mol·L-1,选项A中NH与OH-不能共存;选项B中HCO与OH-不能共存;选项D中CrO为黄色。
答案:C
1.在下列条件下,一定能大量共存的离子组是( )
A. 无色透明的水溶液中,K+、Mg2+、I-、MnO
B.pH=1的NaNO3的水溶液中,NH、Fe2+、SO、Cl-
C.c(HCO)=0.1 mol/L的溶液中,Na+、K+、CO、Br-
D.由水电离产生的c(OH-)=1×10-14 mol/L的溶液中,H+、Al3+、Cl-、NO
解析:A项中,若是无色透明的溶液,则不可能含有MnO;B项中,pH=1时呈酸性,能发生下列氧化还原反应3Fe2++4H++NO===3Fe3++NO↑+2H2O,而不能大量共存;D项中,由水电离产生的c(OH-)=1×10-14 mol/L,则pH=0或pH=14,即溶液呈酸性或碱性,而Al3+在碱性溶液中不能大量存在,即Al3++3OH-===Al(OH)3↓或Al3++
4OH-===[Al(OH)4]-,则D也不能大量共存;C项中HCO、Na+、K+、CO、Br-离子之间不发生反应,故一定能够大量共存。
答案:C
28.6%。
答案:28.6%
20. 在一定条件下,将一定量PCl5(g)通入密闭容器中,发生反应PCl5(g) PCl3(g)+Cl2(g)。
在一定条件下,将一定量PCl5(g)通入密闭容器中,发生反应PCl5(g) PCl3(g)+Cl2(g)。
当达到平衡时,混合气体相对于H2的密度为74.5,则PCl3(g)在平衡混合气体中所占体积分数
是________,简述计算过程
________________________________________________________________________
________________________________________________________________________。
解析:设起始时通入PCl5(g)的物质的量为1 mol,达到平衡时消耗PCl5(g)的物质的量为x,
则
PCl5(g)PCl3(g)+Cl2(g)
1 0 0
x x x
1-x x x
平衡时总物质的量为(1 mol-x)+x+x=1 mol+x。由题意得平衡混合气体的平均摩尔质量
==74.5×2 g·mol-1,解得x=0.40 mol。
故PCl3(g)在平衡混合气体中所占体积分数为×100%=×100%=
18.(2008·宁夏理综,25)已知可逆反应:M(g)+N(g)  P(g)+Q(g);ΔH>0,请回答下列问题:
P(g)+Q(g);ΔH>0,请回答下列问题:
(1)某温度下,反应物的起始浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L;达到平衡后,M的转化率为60%,此时N的转化率为________;
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol/L,c(N)=a mol/L;达到平衡后,c(P)=2 mol/L,a=________;
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L,达到平衡后,M的转化率为________。
解析:(1)M(g) + N(g) P(g)+Q(g)
P(g)+Q(g)
始态 1 mol/L 2.4 mol/L 0 0
变化量 1 mol/L×60% 1 mol/L×60%
因此N的转化率为:×100%=25%
(2)由于该反应的ΔH>0,即正反应为吸热反应,因此升高温度,平衡右移,M的转化率增大。
(3)根据(1)可求出各平衡浓度:
c(M)=0.4 mol/L c(N)=1.8 mol/L,c(P)=0.6 mol/L c(Q)=0.6 mol/L
因此化学平衡常数K===
由于温度不变,因此K不变,达到平衡后
c(P)=2 mol/L c(Q)=2 mol/L,c(M)=2 mol/L c(N)=(a-2)mol·L-1
k===
解得a=6
(4)设M的转化率为x,则达到平衡后各物质的平衡浓度分别为:
c(M)=b(1-x)mol/L c(N)=b(1-x)mol/L,c(P)=bx mol/L c(Q)=bx mol/L
K===,解得x=41%
 答案:(1)25% (2)增大 (3)6 (4)41%
答案:(1)25% (2)增大 (3)6 (4)41%
 19.在A+B 2C的反应中,在某温度下经t
s后混合物中C
19.在A+B 2C的反应中,在某温度下经t
s后混合物中C
的百分含量的变化情况如右图所示。则
(1)A与B化合生成C的反应是 热反应。
(2)温度在475℃以下,随温度升高,C的百分含量增大,这是因为
________________________________________________________________________。
(3)当温度在475℃以上,随温度升高,C的百分含量反而减小,这是因为
________________________________________________________________________。
(4)当温度在475℃时,若B为气态,体系加压时,C的浓度不变,则A、C的状态又如何?
解析:(1)据图象分析:随着温度升高,C%反而降低,故本反应是放热反应。
(2)在475℃以下,是建立平衡阶段,v(正)>v(逆),所以C%增大。
(3)在475℃以上,是因为达平衡后,升温向左移动。v(逆)>v(正),所以生成物的含量反而
减小。
答案:(1)放 (2)建立平衡阶段,v(正)>v(逆),所以C%增大 (3)升温平衡向左移动,
v(逆)>v(正),所以生成物的含量反而减小 (4)A、C均为气态或C为固(液)态
17.恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g)+3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1 mol N2和3 mol H2,达到平衡后,生成a mol NH3,这时N2的物质的量为________mol。
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为________mol和________mol(平衡时NH3的质量分数与(1)中相同)。
(3)若开始时放入x mol N2、6 mol H2和2 mol NH3达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=________,y=________。平衡时H2的物质的量________(选填一个编号)。
A.大于6 mol B.等于6 mol
C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是______________________________________________。
(4)若在(3)的平衡混合物中,再加入6 mol NH3,再次达到平衡后,NH3的质量分数为________。
解析: N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
n(开始) 1 mol 3 mol 0
n(转化) mol a mol a mol
n(平衡) 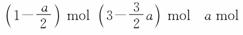
恒温、恒压下,将起始物质转化为方程式同一侧时,物质的量之比相同,即建立等效平衡。故(2)、(3)、(4)均与(1)是等效平衡,达到平衡时NH3的质量分数相同。
答案:(1) (2)3 9 (3)2 3- D
若3a>2,则平衡时H2的物质的量小于6 mol,若3a=2,则平衡时H2的物质的量等于6 mol,若3a<2,则平衡时H2的物质的量大于6 mol(其他合理理由也可) (4)50a%
2.取5支试管,编号分别为1,2,3,4,5,然后各取步骤(1)中FeCl3和KSCN的混合溶液4 Ml
加到5支试管中。往1号试管滴加2-3滴1.0 mol/L FeCl3溶液,振荡,观察现象;往2
号试管滴加2-3滴1.0 mol/L KSCN溶液,振荡,观察现象;往3号试管中加入少量KCl
固体,振荡,观察现象;往4号试管中滴加2-3滴1.0 mol/L NaF溶液,振荡,观察
现象。
根据你所学的内容完成下列表格,并回答有关问题。
FeCl3与KSCN溶液反应
|
编号 |
混合溶液颜色 |
滴加的溶液 |
溶液颜色的变化 |
平衡移动的方向 |
|
1 |
橙红色 |
FeCl3 |
①颜色______了,由橙红色变成了______色 |
③向______移动 |
|
2 |
橙红色 |
KSCN |
②颜色______了,由橙红色变成了______色 |
④向______移动 |
|
3 |
橙红色 |
KCl |
颜色变浅了,由橙红色变成了黄色 |
⑤向______移动 |
|
4 |
橙红色 |
NaF |
颜色变浅了,由橙红色变成了无色 |
⑥向______移动 |
|
5 |
橙红色 |
- |
橙红色 |
不移动 |
(1)由①②现象说明假设______成立,假设______不成立。
 (2)根据Fe3++3SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象
(2)根据Fe3++3SCN- Fe(SCN)3,加入KCl固体,颜色不应该有变化,但现象
却是变浅了,请你分析变浅的可能原因是
________________________________________________________________________。
(3)根据“4”号试管中的现象,分析在4号试管中发生的变化是____________,说明了
__________(从改变浓度影响平衡移动角度回答)
 解析:FeCl3与KSCN发生的化学反应为:FeCl3+3KSCN Fe(SCN)3+3KCl,Fe3
解析:FeCl3与KSCN发生的化学反应为:FeCl3+3KSCN Fe(SCN)3+3KCl,Fe3
 +3SCN- Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,
+3SCN- Fe(SCN)3。加入FeCl3或KSCN(增大反应物浓度)会使平衡向右移动,
颜色加深,加入KCl固体,颜色变浅,说明平衡向左移动,可能是加入的Cl-与Fe3+形
成配位离子,减小了Fe3+的浓度。加入NaF溶液变为无色,说明F-与Fe3+形成了比
Fe(SCN)3更稳定的配位化合物,使平衡向左移动。
答案:①加深 血红 ②加深 血红 ③右 ④右 ⑤左 ⑥左 (1)1 2 (2)Fe3+与Cl
-形成络离子,使Fe3+浓度减小,平衡向左移动 (3)F-与Fe3+形成了无色的且比Fe(SCN)3
稳定的化合物(络合物) 减小反应物的浓度会使平衡向逆反应方向移动。
1.往250 mL烧杯中加入100 mL蒸馏水,然后加入10 mL 0.01 mol/L FeCl3溶液,再加
入10 mL 0.01 mol/L KSCN溶液,溶液由黄色变成橙红色。
16.探究性问题在理论指导元素化合物实验具有重要意义。
[问题]
对于已达平衡的可逆反应,当其它条件不变时,改变反应物或生成物的浓度会对化学平
衡有何影响?
[猜想与假设]
假设1:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向正反应方
向移动。
假设2:化学反应处于平衡状态时,其它条件不变,增加反应物浓度,使平衡向逆反应方
向移动。
假设3:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向逆反应方
向移动。
假设4:化学反应处于平衡状态时,其它条件不变,增加生成物浓度,使平衡向正反应
方向移动。
[设计和实施方案]
在已反应平衡的FeCl3和KSCN的混合液中,分别加入:①FeCl3溶液 ②KSCN溶液
③KCl固体 ④NaF溶液
实验用品:仪器:烧杯、玻璃棒、胶头滴管
试剂:FeCl3(aq)(0.01 mol/L,1.0 mol/L),KSCN(aq)(0.01 mol/L,1.0 mol/L),KCl(s),
NaF(aq)(1.0 mol/L)。
实验步骤:
15. 在实验室进行工业合成氨的模拟实验:
N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
当反应达到平衡后,分离出氨,并补充氮气、氢气物质的量之比与起始时相同的原料气,以实现连续生产,各组分物质的量和时间的关系如下图所示。

(1)起始时刻氮气与氢气的物质的量之比n(N2)∶n(H2)=________。反应开始至15 min时第一次达到平衡,容器体积为1 L,这段时间内,以NH3的浓度变化表示的平均反应速率是________。
(2)写出代表H2的曲线在下列时刻的坐标并在图上画出t1-t2间的曲线:
t1补充原料气之后:(________,________);t2处于平衡状态时:(________,________)。
(3)第一次达平衡时H2的转化率是________。
以t1补充原料气之后为起始状态,第二次达到平衡时H2的转化率是________。
以这样的氮气和氢气的物质的量之比补充原料气,试计算经济上是否合算?
解析:(1)观察图像的起点,氮气为1.00 mol,氢气为3.30 mol,其比值为:1∶3.3;纵坐标每小格为0.20 mol,则v(NH3)=0.20 mol/(1 L×15 min)=0.013 3 mol/(L·min)。
(2)第一次平衡时,氮气的物质的量为0.90 mol,在t1时,加入氮气应为0.10 mol,再根据“补充氮气、氢气物质的量之比与起始时相同的原料气”,可求出应加入的氢气的物质的量为:0.10 mol×3.3=0.33 mol,而第一次平衡时,氢气为3.00 mol,故t1补充原料气之后的坐标为(25,3.33);第二次平衡时,生成氨气仍为0.20 mol,消耗的氢气为0.30 mol、氮气为0.10 mol,故平衡气体中,氢气的物质的量为(3.33-0.30) mol,t2处于平衡状态时的坐标为(50,3.03)。
(3)第一次平衡时氢气的转化率为:(0.30 mol/3.30 mol)×100%=9.09%;
第二次平衡时氢气的转化率为:(0.30 mol/3.33 mol)×100%=9.01%;第二次的转化率低,不合算。
答案:(1)1∶3.3 0.013 3 mol/(L·min)
(2)(25,3.33) (50,3.03)(右图)
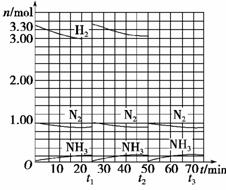
(3)9.09% 9.01% 不合算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com