
题目列表(包括答案和解析)
3. 某元素X,其原子的电子层数为(n-1),最外层电子数为(2n-1)。下列有关元素X的说法中正确的是( )
①元素X 可能是金属元素 ②元素X的气态氢化物一定极易溶于水 ③元素X的最高价氧化物的水化物一定是强酸 ④元素X的气态氢化物分子间一定不能形成氢键
A.①③ B.②③ C.①④ D.③④
解析:只有当n=3或4时,才能推出合理结论,X为N或Cl,故①错,②③正确。NH3分子间能形成氢键,④错。
答案:B
2.K、L、M三种主族元素,已知K+和L-具有相同电子层结构,M元素原子核电荷数比L元素原子核电荷数少9,L-在一定条件下可被氧化成LM,则下列说法正确的是( )
A.K、L、M均属于短周期元素
B.离子半径K+>L-
C.K、L、M三种元素组成的化合物中既含有离子键又含有共价键
D.L的气态氢化物可形成氢键
解析:根据题设条件可推知K为K、L为Cl、M为O。选项A,K是第四周期元素,不是短周期元素。选项B,电子层结构相同的微粒,原子序数越小,其微粒半径越大,Cl-半径大于K+半径。选项C,如KClO,K+与ClO-以离子键结合,Cl原子与O原子以共价键结合。选项D,HCl分子间不存在氢键。
答案:C
1.(2009·江苏,2)下列有关化学用语使用正确的是( )
A.硫原子的原子结构示意图:
B.NH4Cl的电子式: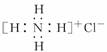
C.原子核内有10个中子的氧原子:
D.对氯甲苯的结构简式: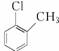
解析:本题考查化学用语,意在考查考生对原子结构示意图、电子式,原子构成、有机物的结构简式的掌握。A项,硫原子的原子结构示意图应为 ;B项,电子式应为
;B项,电子式应为 ;C项,正确;D项,对氯甲苯的结构简式为
;C项,正确;D项,对氯甲苯的结构简式为 。
。
答案:C
20.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是________。
(4)F是由两种元素组成的三原子分子,其分子式是________。
(5)G分子中含有4个原子,其分子式是________。
(6)H分子中含有8个原子,其分子式是________。
解析:含有18电子的微粒有
分子:SiH4、PH3、H2S、HCl、Ar、F2、H2O2、C2H6、CH3OH等;
离子:S2-、HS-、Cl-、P3-、O、K+、Ca2+等。总结出了以上规律,各小问自然能够顺利解出。
答案:(1)K Cl S (2)HCl (3)F2 (4)H2S (5)H2O2(答PH3同样给分) (6)C2H6
20. A、B、C、D为原子序数小于18的四种元素:
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布。
推断A-D各为何种元素,并填空:
(1)A________;B________;C________;D________。
(2)四种元素离子半径的大小顺序为_____________________________________________。
(3)用离子方程式表示D2B水溶液呈碱性的原因__________________________________。
解析:A、B、C、D均为短周期元素。由①可知A的族序数等于周期数,可能为H、Be、Al。由②可知;短周期可形成D2B离子化合物有Li2O、Na2O、Na2S,它们的水溶液为碱性。由③可知若C为阴离子Cn-,则设核电荷数c,有2c+n=18(n取偶数),n=2时,c=8,为O,O2-离子在熔融的金属氧化物中存在。n=4时,c=7为N,无N4+离子,舍去,n不可能大于5。若C为阳离子Cn+,由2c-n=18(n取偶数),n=2时,c=10,为Ne,舍去;n=4时,c=11为Na,无Na4+,舍去;n=6时,c=12,为Mg,无Mg6+舍去,故C为O元素,由④知A、C、D必为相邻周期元素。所以C为O,则A为Al,D为Na。
答案:(1)Al S O Na (2)r(S2-)>r(O2-)>r(Na+)>r(Al3+)
(3)S2-+H2O HS-+OH- HS-+H2O
HS-+OH- HS-+H2O H2S+OH-
H2S+OH-
19.(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________。
(2)已知某粒子的结构示意图为:
试回答:
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称)________、________、________、________、________。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式________________________________________________________________________。
解析:(1)设:核电荷数=质子数=a,元素原子的电子层数为x,最外层电子数为y,依题意:a=5x,a=3y,则5x=3y,x=3y/5。因原子的最外层电子数不超过8,即y为1-8的正整数,故仅当y=5,x=3合理,该元素的核电荷数为15。
(2)①当x-y=10时,x=10+y,说明核电荷数等于核外电子数,所以该粒子应为原子;②当y=8时,应为有18个电子的粒子,所以可能为氩原子、氯离子、硫离子、钾离子、钙离子;③y=3时为铝原子、y=7时为氯原子,其最高价氧化物对应的水化物分别为氢氧化铝和高氯酸,反应的离子方程式为Al(OH)3+3H+===Al3++3H2O。
答案:(1)  (2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子 ③Al(OH)3+3H+===Al3++3H2O
(2)①原子 ②氩原子 氯离子 硫离子 钾离子 钙离子 ③Al(OH)3+3H+===Al3++3H2O
18.现有部分元素的性质与原子(或分子)结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
T |
最外层电子数是次外层电子数的3倍 |
|
X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
|
Y |
M层比K层少1个电子 |
|
Z |
第3周期元素的简单离子中半径最小 |
(1)画出元素T的原子结构示意图____________。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式___________________________________________________________________。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式_______________________________________
________________________________________________________________________。
解析:由表中信息可知:T为氧元素,X为氮元素,Y为钠元素,Z为Al元素。Na比Al金属性强,相关实验事实为:与水反应Na比Al剧烈;最高价氧化物水化物的碱性NaOH比Al(OH)3强。上述元素中,由其中两种元素形成的既有离子键又有非极性共价键的物质常见的是Na2O2。氧元素与氢元素形成的原子个数比为1∶1的化合物Q是H2O2。氮元素与氢元素形成的原子个数为1∶2的化合物是N2H4,两者反应可生成N2和H2O。
答案:(1) 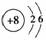 (2)Na c、d (3)Na2O2 (4)N2H4+2H2O2===N2+4H2O
(2)Na c、d (3)Na2O2 (4)N2H4+2H2O2===N2+4H2O
17.设X、Y、Z代表3种元素。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y原子核内质子数少9个;
③Y和Z两种元素可以形成4核42个电子的负一价阴离子。
据此, 请填空:
(1)写出X、Y、Z三种元素的名称X________,Y________,Z________。
(2)写出X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式:________________________________________________________________________。
解析:由②③推测4核42电子的负一价阴离子为ClO,则Y为Cl,Z为O,那么X为K。
答案:(1)钾 氯 氧 (2)OH-+H+===H2O
16. 通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A:________;B:________;C:________;D:________。
(2)写出A、B、E三种微粒反应的离子方程式:________________________________________。
解析:常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、
Mg2+、Al3+、NH、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,从而得出答案。
答案: (1)H2O NH3 NH OH- (2)Al3++3NH3+3H2O===Al(OH)3↓+3NH或
Mg2++2NH3+2H2O===Mg(OH)2↓+2NH
15.短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是________;Y元素的名称是________;Z元素的名称是________。
(2)XZ3化合物的分子式是______,电子式是______。
(3)分别写出X、Y的含氧酸的分子式______、______。
解析:由Y入手进行推断,Y元素原子的最外电子层上的电子数是它的电子层数的2倍,可推断Y为C,不可能是S(S为3个电子层,若为S,另外两种元素只可能为H和He,与题意不符),由XZ3结合题设可推断为NH3。
答案:(1)氮 碳 氢 (2)NH3 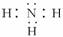 (3)HNO3或HNO2 H2CO3或H2C2O4等有机酸
(3)HNO3或HNO2 H2CO3或H2C2O4等有机酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com