
题目列表(包括答案和解析)
14.下图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置。

回答下列问题:
(1)请在上图中将过渡元素所在的位置涂黑。
(2)工业上用于冶炼M的化学方程式为_________________________________________。
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域。其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1∶1∶3,该反应的化学方程式为________________,反应中________作氧化剂。
(4)图中A、B两元素形成的离子B2A中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是____________,依据是___________________________________________________。
解析:三角形元素周期表的实质是将原周期表的空隙部分进行了删除形成的,与原元素周期表没有本质的区别,所以表中R为氮,A为氧,M为铝,B为硫,在第四周期之后的ⅡA和ⅢA之间为过渡元素,据此便可顺利回答有关问题了。
答案:(1)见下图

(2)2Al2O34Al+3O2 (3)Al2O3+N2+3C2AlN+3CO N2
(4)氧化性 离子结构中存在-O-O-(部分氧元素呈-1价亦可)
13.A、B、C和D均为短周期元素组成的非金属单质。其中B、C、D在常温下为气态,A为 固体,W为含42个电子的离子化合物。它们满足如图的转化关系(反应条件略)。
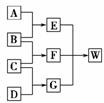
(1)已知E为直线型的非极性分子,则E的结构式为__________________;D单质的电子式为______;G中两元素的原子个数比为1∶3,则G分子的空间构型为__________。
(2)C+DG的化学方程式为_____________________________________________________。
(3)已知短周期元素X与B中的元素位于同一主族,则X的最高价氧化物对应水化物的浓溶液与A反应的化学方程式为____________________________________________________。
(4)20℃时将G与E通入饱和食盐水中,有晶体析出,写出该反应的化学方程式________________________________________________________________________。
解析:短周期元素组成非金属气态单质有氧气、氢气、氮气、氟气和氯气。由(1)问题知,E为直线型非极性分子,联系CO2、C2H2,由G分子中原子个数比知,G为氨,再根据框图推知,A为固体单质碳,B为氧气,C为氢气,D为氮气,E为二氧化碳,F为水。W为碳酸氢铵,含42电子的离子化合物,符合题意。根据试卷前面提示的几种物质的溶解度可知在饱和氯化钠溶液中通入二氧化碳和氨气只可能析出碳酸氢钠,因为碳酸氢钠在这些物质中溶解度最小。
答案:(1)O===C===O N⋮⋮N 三角锥型
(2)N2+3H2 2NH3
2NH3
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(4)CO2+NH3+NaCl+H2O===NaHCO3↓+NH4Cl
12.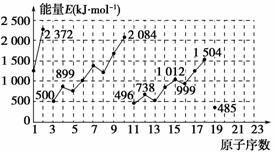 下图为不同元素的气态原子失去最外层一个电子所需要的能量。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
下图为不同元素的气态原子失去最外层一个电子所需要的能量。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
上图所示为1~19号元素气态原子失去最外层一个电子所需能量(E,单位为kJ/mol)。
(1)同主族内不同元素的E值的变化特点是 。各主族中E值的这种变
化体现了元素性质的 变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象,试预测下列
关系中正确的是 (填写编号)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围: <?
E< 。
(4)10号元素E值较大的原因是 。
解析:此题考查了元素第一电离能的变化规律和归纳总结能力。(1)从H、Li、Na、K等
可看出,同主族元素随元素的原子序数的增大,E值变小;H到He、Li到Ne、Na到Ar
呈现明显的周期性。(2)从二、三周期可看出,第ⅢA和ⅣA族元素比同周期相邻元素的
E值都低。由此可推测E(砷)>E (硒)<E (溴)。(3)根据同主族、同周期规律可推测:
E (K)<E (Ca)<E (Mg)。(4)10号元素是稀有气体,该元素的原子最外层电子排布已达
8电子稳定结构。
答案:(1)随着原子序数的递增, E值变小 周期性
(2)①③ (3)485 738
(4)10号元素为氖元素,该元素原子的最外层电子排布已达8电子稳定结构
11. 下表是元素周期表的一部分,表中所列字母分别代表十种化学元素,就表中字母所代表的元素回答下列问题。

(1)铅(原子序数为82)从单质到其化合物都有着广泛的应用,如制造焊锡、铅蓄电池、化工耐酸设备以及X射线的防护材料等。铅的氧化物主要有三种:PbO、PbO2和Pb3O4。请回答下列问题:
①铅位于元素周期表中第______周期第______族;
②PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应的离子方程式:________________________________________________________________________。
(2)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图________________________________________________________________________。
(3)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑。请预测首先被用来与F2反应制备稀有气体化合物的元素是______(填写字母)。利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式_______________________________________________。
解析:82=2+8+18+32+18+4,铅位于第六周期第ⅣA族。PbO2+2NaOH===Na2PbO3+H2O
稀有气体化学性质相对稳定,从上至下,稀有气体元素活泼性增强。所以,最先制得j的氟化合物。
答案:(1)①六 ⅣA ②PbO2+2OH-===PbO+H2O (2) 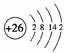 (3)j XeO3+3NaBrO33NaBrO4+Xe
(3)j XeO3+3NaBrO33NaBrO4+Xe
10.A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是( )
A.A、C两元素处在元素周期表中的第ⅣA族
B.B、D两元素组成的离子化合物中阴、阳离子的个数比为1∶1
C.B、C、D三种元素组成的化合物的化学式为DCB2
D.B、C、D三种元素的简单离子的半径大小顺序为:C>D>B
解析:因A、C同主族,且为短周期元素,所以其原子序数相差2或8,若相差2,显然不合题意;又因C原子核内的质子数等于A、B原子核内的质子数之和,可以推测B为8号元素,为氧元素;C原子最外层电子数是D原子最外层电子数的3倍,若D的最外层电子数为1,则C为铝,A为硼,D为钠;若D的最外层电子数为2,则C为硫,A为氧,显然不合题意;据此可知,选项A、D不正确,C正确;由于Na2O中阴、阳离子的个数比为1∶2,所以选项B不正确;选C。
答案:C
9. 有X、Y、Z、W四种含氧酸,其成酸元素均为元素周期表中的短周期元素。将分别含有一定质量的X、Y、Z、W的水溶液进行光照或微热(有关的反应均进行完全),测得的数据如下表:
|
含氧酸 |
X |
Y |
Z |
W |
|
含氧酸的质量/g |
25.2 |
a |
3.1 |
10.5 |
|
生成物U的质量/g |
3.2 |
/ |
/ |
3.2 |
|
生成物V的质量/g |
3.6 |
0.9 |
0.9 |
/ |
|
不同生成物Q的质量/g |
18.4 |
3.2 |
b |
c |
据此判断下列叙述正确的是( )
A.表中的数据a=5.1 g
B.含氧酸Y为硫酸
C.四种含氧酸的成酸元素的化合价分别为+4、+5
D.四种含氧酸中有一种是强电解质、三种是弱电解质
解析:在常见含氧酸中,光照或加热分解产物有三种的有硝酸,据此可以确定X为HNO3,则U为O2,V为H2O,Q为NO2;由质量守恒可知a=0.9+3.2=4.1,b=3.1-0.9=2.2 g,c=10.5-3.2=7.3,并由此可以确定Y为H2SO3,Z为H2CO3,W为HClO,所以选项D正确,A、B、C不正确;选D。
答案:D
8.下列微粒半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2- B.S2-<Cl-<Na+<Al3+
C.Na<Mg<Al<S D.Cs>Rb>K>Na
思路分析:在现阶段对除稀有气体元素原子以外的任何原子或离子的半径进行比较要“三看”:①首先看层,层少半径小;②同层看核,核大半径小;③同核看价,价高半径小。
解析:A项中Na+、Mg2+、Al3+、O2-都具有相同的电子层结构,核电荷数越大,微粒半径越小,即微粒半径由大到小的顺序是O2->Na+>Mg2+>Al3+,A选项不正确。B项中,S2-和Cl-具有相同的电子层结构,由上述规律知:r(S2-)>r(Cl-),同理r(Na+)>r(Al3+),但Cl-比Na+多一个电子层,显然r(Cl-)>r(Na+),故离子半径大小是S2-<Cl-<Na+<Al3+,B选项不正确。C选项中,Na、Mg、Al、S的电子层数相同,核电荷数越大,半径越小,即:Na>Mg>Al>S,故C选项错误。D中,Cs、Rb、K、Na的最外层电子数相同,电子层数逐渐减少,其原子半径Cs>Rb>K>Na,故D选项正确。
答案:D
7.如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号。已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是( )

A.原子半径X<Y
B.最高价氧化物对应的水化物酸性X>Y
C.X的氢化物具有强还原性
D.Y与碘同周期,Y最高价氧化物对应的水化物酸性比高碘酸(HIO4)强
解析:X的氢化物化学式为XH3,说明X处于ⅤA族,XH3有剧毒,是AsH3,有强还原性,C正确。Y比X多1个电子层,则原子半径Y>X。X非金属性强于Y,B正确。Y与碘同周期,则Y非金属性比I弱,则最高价氧化物对应的水化物比HIO4弱。
答案:D
6.一定条件下,氨气与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是( )
A.NF3是三角锥型分子
B.NF3既是氧化产物,又是还原产物
C.NH4F中既含有离子键又含有共价键
D.上述反应中,反应物和生成物均属于共价化合物
解析:反应中N:-3―→+3,F:0―→-1,NF3类似NH3是极性分子,NF3既是氧化产物又是还原产物,D选项中NH4F是离子化合物。
答案:D
5. 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8 B.NH3的结构式为
C.HCl的电子式为 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
解析:本题主要考查氢化物的表示方法及性质。一个重氢原子D含有一个中子,一个氧原子含有8个中子,故1个D2O分子中所含中子数为10个,A项不正确;HCl为共价化合物,其电子式为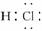 ,C项错误;由于硫的非金属性比氟弱,其氢化物H2S的稳定性比HF弱。
,C项错误;由于硫的非金属性比氟弱,其氢化物H2S的稳定性比HF弱。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com