
题目列表(包括答案和解析)
7.(2009·河南统考)X、Y、Z、W是中学化学中常见的四种元素,它们的原子序数依次增大。化学式为W3Y4的物质具有磁性。X的单质在Y2中燃烧可生成化学式为XY和XY2的两种气体。Z的单质是金属,Z在XY2中剧烈燃烧生成黑、白两种固体。下列有关说法中错误的是( )
A.W3Y4的化学式为Fe3O4
B.W在地壳中的含量居第四位
C.XY和XY2分别是NO和NO2
D.金属单质Z在XY2中燃烧生成的白色固体的化学式为MgO
解析:由W3Y4具有磁性可推知该物质为Fe3O4;根据Z的单质是一种金属,该金属在XY2中剧烈燃烧生成黑、白两种固体可推知,Z为Mg,XY2为CO2,故选项C错误;金属单质Z在XY2中燃烧生成的白色固体的化学式为MgO。
答案:C
|
|
R |
|
|
X |
Y |
Z |
6.下图中每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是( )
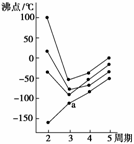
A.H2S B.HCl
C.PH3 D.SiH4
解析:在ⅣA-ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,故a点代表的应是SiH4。
答案:D
5.下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.同一主族的两种元素的原子序数之差不可能是36
C.镁的一种放射性同位素28Mg的原子核内的中子数是12
D.常温常压下,气态单质的分子都是由非金属元素的原子构成的
解析:常温常压下,非金属单质的Br2,金属单质的Hg都是液态的;同一主族相邻的两种元素的原子序数之差是2、8、18、32不相邻的可以是36,如K(19号)和Cs(55号);28Mg的原子核内的中子数是16,即A、B、C错误。
答案:D
4. (2008·广东理基)下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期 ⅡA族
A.①② B.①③ C.②④ D.③④
解析:原子序数为15的元素是P,最高化合价为+5价,①错误;在元素周期表中同一周期随原子序数递增非金属性逐渐增强,②正确;C的质子数为6,但中子数不一定为6,因C存在14C和13C等同位素,③错误;原子序数为12的元素为Mg,④正确。
答案:C
3.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色的气体产生,则下列说法正确的是( )
A.X2+具有强还原性 B.XCl2溶液呈酸性
C.XO2具有强氧化性 D.该元素是ⅡA族
解析:X2+离子最外层为2个电子,故X原子最外层有4个电子,应为ⅣA族,XO2能氧化盐酸,所以X2+还原性较差,而XO2氧化性较强,XCl2(实际为PbCl2)是由强酸弱碱组成的盐,水解呈酸性。
答案:BC
2.酸根RO所含电子数比硝酸根NO的电子数多10,则下列说法正确的是( )
A.R原子的电子层数比N原子的电子层数多1
B.R的最高化合价与N的最高化合价相等
C.RO和NO只能被还原,不能被氧化
D.R和N为同族元素
解析:RO和NO所带电荷数一样,又因为酸根RO所含电子数比硝酸根NO的电子数多10,所以R和N不是同一族,R为Cl,最高价为+7,O既能被还原,又能被氧化。
答案:A
1.“过渡金属氧化物研究”被《科学》杂志评为2007年世界十大科技突破之一。下列对过渡金
属氧化物的叙述正确的是 ( )
A.氧化铜、氧化锌、氧化钡都是过渡金属氧化物
B.铝热反应指铝能与所有的金属氧化物发生置换反应
C.二氧化锰可以作为氯酸钾、双氧水分解的催化剂
D.元素周期表中“分界线”附近寻找过渡金属
解析:钡位于第ⅡA族,属于主族元素,A错。铝在高温下与过渡金属氧化物发生置换反应,但与氧化钠、氧化镁等氧化物不能发生置换反应,B错。在元素周期表中“分界线”附近的元素都是主族元素,没有过渡元素,D错。
答案: C
17.(2009·福建理综,23)短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:

(1)T的原子结构示意图为________。
(2)元素的非金属性(原子的得电子能力):Q________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为________________________________________________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________。
(6)在298 K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298 K下的ΔH=________(注:题中所涉单质均为最稳定单质)。
解析:由四种短周期元素在周期表中的位置可知T在第三周期,由于T所处的周期序数与主族序数相等,则T在ⅢA族为Al,则可推Q是C,R是N,W是S。(1)Al原子结构示意图为: 。(2)由硫酸的酸性强于碳酸可知硫元素非金属性强于碳元素,即Q弱于W。(3)S单质与浓硫酸可发生氧化还原反应生成SO2气体,因为产物只有两种,产物中一定含H2O,则另一种为SO2,则反应化学方程式为:S+2H2SO4(浓)3SO2↑+2H2O。(4)比氮原子序数多1的元素是氧元素,其一种氢化物H2O2可分解生成它的另一种氢化物H2O,方程式为:2H2O22H2O+O2↑。(5)N的氧化物中相对分子质量最小的是NO,由反应方程式:2NO+O2===2NO2可知2 L NO与0.5 L O2混合后生成1 L NO2及余1 L NO,再由反应:NO+NO2+2NaOH===2NaNO2+H2O,混合气体被完全吸收后生成一种N的含氧酸盐为NaNO2。(6)由题目信息可知:4Al(s)+3O2(g)===2Al2O3(s);ΔH=-4b kJ/mol①,C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol②,①-②×3可得:4Al(s)+3CO2(g)===2Al2O3(s)+3C(s);ΔH=(3a-4b)
kJ/mol。
。(2)由硫酸的酸性强于碳酸可知硫元素非金属性强于碳元素,即Q弱于W。(3)S单质与浓硫酸可发生氧化还原反应生成SO2气体,因为产物只有两种,产物中一定含H2O,则另一种为SO2,则反应化学方程式为:S+2H2SO4(浓)3SO2↑+2H2O。(4)比氮原子序数多1的元素是氧元素,其一种氢化物H2O2可分解生成它的另一种氢化物H2O,方程式为:2H2O22H2O+O2↑。(5)N的氧化物中相对分子质量最小的是NO,由反应方程式:2NO+O2===2NO2可知2 L NO与0.5 L O2混合后生成1 L NO2及余1 L NO,再由反应:NO+NO2+2NaOH===2NaNO2+H2O,混合气体被完全吸收后生成一种N的含氧酸盐为NaNO2。(6)由题目信息可知:4Al(s)+3O2(g)===2Al2O3(s);ΔH=-4b kJ/mol①,C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol②,①-②×3可得:4Al(s)+3CO2(g)===2Al2O3(s)+3C(s);ΔH=(3a-4b)
kJ/mol。
答案:(1)  (2)弱于 (3)S+2H2SO4(浓)3SO2↑+2H2O (4)2H2O22H2O+O2↑ (5)NaNO2 (6)(3a-4b) kJ·mol-1
(2)弱于 (3)S+2H2SO4(浓)3SO2↑+2H2O (4)2H2O22H2O+O2↑ (5)NaNO2 (6)(3a-4b) kJ·mol-1
16.锶(Sr)位于元素周期表的第5周期ⅡA族。碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含不溶性杂质)为原料,采用以下两种方法制取碳酸锶,进而制得多种锶的化合物。
方法一:将天青石粉碎后在1 000℃-1 200℃时与碳在还原气氛中反应制得硫化锶。向硫化锶溶液中通入CO2得到碳酸锶。
方法二:将天青石粉末与碳酸钠溶液的混合物在90℃时加热1-2 h,经过滤、洗涤,得到碳酸锶。
(1)方法一将天青石粉碎的目的是_______________________________________________。
写出用碳还原天青石反应的化学方程式:________________________________________。
(2)方法二的反应能够发生,说明________________________________________________。
为了使该反应充分进行,还可以采取的措施是_____________________________________。
(3)两种方法中得到的碳酸锶纯度较高的是________(填“方法一”或“方法二”),理由是________________________________________________________________________。
(4)下列关于锶及其化合物的叙述中,正确的是________。
A.离子半径:Ba2+>Sr2+>Ca2+>Be2+ B.碱性:Ba(OH)2>Sr(OH)2>Ca(OH)2
C.SrCO3高温分解可以制取SrO D.SrCO3与HNO3溶液反应可制取Sr(NO3)2
解析:通过同主族元素的相似性,将不熟悉的锶看作较为熟悉的钙进行分析、思考,是解答本题的有效途径之一。方法一中将天青石粉碎的目的是增加反应物的接触面积,提高化学反应速率和原料的利用率,碳还原天青石的化学方程式见答案;方法二是利用碳酸锶的溶解度小于硫酸锶,溶解沉淀平衡向离子减少的方向进行的原理,在反应过程中不断搅拌可以提高反应的速率和效率;方法二的最大缺点是不能及时除去碳酸锶中的不溶性杂质。
答案:(1)增加反应物接触面积,提高反应速率和原料的利用率
4C+SrSO4SrC+4CO↑ (2)碳酸锶的溶解度小于硫酸锶的溶解度 搅拌 (3)方法一 硫化锶可溶于水,通过过滤可以除去不溶性杂质 (4)ABCD
15. 现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
能形成双原子分子,原子间存在3对共用电子对 |
|
X |
M层有3个电子 |
|
Y |
最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维 |
|
Z |
最高正价为+7价 |
(1)写出元素Z的离子结构示意图________________。Y的最高价氧化物中,化学键Y-O的物质的量与Y的物质的量之比为:________(填数字)。
(2)X的最高价氧化物与烧碱反应的离子反应方程式为:________________。
(3)Z的非金属性比T元素强,用化学方程式表示:________________________。
(4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目。________________________________________________________________________。
解析:由题给已知可以推出T为氮,X为铝,Y为硅,Z为氯;据此回答有关题设问题便可水到渠成了,具体见答案。
答案:(1) 4 (2)Al2O3+2OH-+3H2O===2[Al(OH)4]- (3)3Cl2+2NH3===N2+6HCl(或3Cl2+8NH3===N2+6NH4Cl) (4)
4 (2)Al2O3+2OH-+3H2O===2[Al(OH)4]- (3)3Cl2+2NH3===N2+6HCl(或3Cl2+8NH3===N2+6NH4Cl) (4) 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com