
题目列表(包括答案和解析)
22.(2009·海南单科,20-4)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂
为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
(1)氨催化氧化的化学方程式为
________________________________________________________________________;
(2)原料气中空气必须过量,其主要原因是
________________________________________________________________________;
(3)将铂铑合金做成薄丝网的主要原因是
________________________________________________________________________;
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为________________,为了提
高水对二氧化氮的吸收率,可采取的措施为
________________________________________________________________________
(答2项)。
答案:(1)4NH3+5O2Pt-Rh高温4NO+6H2O (2)提高氨的转化率和一氧化氮的转化率
(3)增大单位质量的催化剂和反应物的接触面积 (4)3NO2+H2O===2HNO3+NO
加压 降温
21.现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH、Cl-、Mg2+、
Ba2+、CO、SO,现取三份100 mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,在标准状况下收集到气体0.896 L气体;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,回答下列问题:
(1)原溶液中一定存在的离子有______________,一定不存在的离子有____________,可
能存在的离子有_______________________________________________。
(2)写出实验③发生反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
(3)请你设计实验,确认可能存在离子的情况
________________________________________________________________________。
解析:根据①可知原溶液中至少含有Cl-、CO、SO的一种;根据②可知原溶液中含有0.896 L/22.4 L·mol-1=0.04 mol NH;根据③可计算出含有0.02 mol CO,0.01 mol SO,故原溶液中不存在Mg2+、Ba2+,可能存在Cl-;根据电荷守恒,阴离子的电荷至少为0.06 mol,而NH的电荷为0.04 mol,故原溶液中含有K+。Cl-的检验要排除CO和SO的干扰。
答案:(1)CO、SO、NH、K+ Mg2+、Ba2+ Cl- (2)Ba2++CO===BaCO3↓,
Ba2++SO===BaSO4↓, BaCO3+2H+===Ba2++CO2↑+H2O (3)取一定量的原溶液置于试管中,向其中加入足量的稀HNO3和Ba(NO3)2溶液,静置,向上层清液中加入AgNO3溶液,如有白色沉淀生成则有Cl-,如无白色沉淀生成则无Cl-
20.有一瓶白色固体,取少量置于试管中加热,固体逐渐消失,放出水蒸气和其他两种气体,试管内除管口有少量水珠外,没有任何残留物。取0.350 g这种固体跟过量的碱液反应,
生成一种能使湿润的红色石蕊试纸变蓝的气体,这些气体正好能和30.0 mL 0.100 mol/L
H2SO4完全反应;另取0.350 g该固体跟足量盐酸反应,放出一种无色、无臭的气体,将这
些气体通入过量的澄清石灰水中,得到0.400 g白色沉淀。
(1)计算0.350 g固体中含有的阴离子和阳离子的物质的量________。
(2)根据实验及计算结果确定白色固体是________?判断的依据是
________________________________________________________________________。
解析:(1)从固体与碱液共热时放出能使湿润的红色石蕊试纸变蓝的气体,证明有NH存在;
从固体与酸反应所生成的气体能与石灰水作用产生白色沉淀,证实固体中有CO或HCO。
n(CO或HCO)=n(CaCO3)==0.004 mol。
n(NH)=2×0.0300 L×0.100 mol/L=0.006 mol。
(2)从固体加热分解后,试管内没有任何残留物,以及生成除水蒸气之外只有两种气体,说
明该固体中不含任何固体金属离子和其他酸根离子。所以该固体可能是(NH4)2CO3或
NH4HCO3或其混合物。
在(NH4)2CO3中,NH和CO的物质的量之比为2∶1,在NH4HCO3中,NH和HCO的
物质的量之比为1∶1,该固体中,NH和CO(或HCO)物质的量之比为0.006∶0.004=1.5∶1,所以该白色固体是(NH4)2CO3和NH4HCO3的混合物。
答案:(1)0.004 mol;0.006 mol (2)(NH4)2CO3和NH4HCO3的混合物;判断依据略。
19.一种无色气体,可能是由CO2、HCl、NH3、NO2、NO、H2中的一种或几种所组成,将此无色气体通过盛有浓H2SO4的洗气瓶,发现气体减少一部分体积,继续通过装有固体Na2O2的干燥管,发现从干燥管出来的气体显红棕色。再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内盛满液体。因此可以确定:
(1)原气体一定含有____________________。
(2)一定不会有____________________。
(3)由最终结果可知原气体中,__________________气体的体积比为__________________。
解析:“无色气体”则不含NO2;“通过盛有浓H2SO4的洗气瓶,发现气体减少一部分体积”,说明一定含有NH3,则一定不含HCl;“继续通过装有固体Na2O2的干燥管,发现从干燥管出来的气体显红棕色”,说明此时气体中有NO2,则原混合气体中一定含有NO和CO2;“再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内盛满液体”,说明NO2和O2的体积比为4∶1,亦即NO和O2的体积比为4∶3,4NO2+O2+2H2O===4HNO3或4NO+3O2+2H2O===4HNO3,再据2CO2+2Na2O2===2Na2CO3+O2,可知NO和CO2的体积之比为4∶(3×2)=2∶3,并且原混合气体中不含H2。
答案:(1)NH3、CO2、NO (2)HCl、NO2、H2 (3)NO和CO2 2∶3
20.25 L·mol-1,则该溶液的物质的量浓度是________。
解析:该探究实验利用了:2NO+O2===2NO2,4NO2+O2+2H2O===4HNO3两个反应。
得到的HNO3溶液的物质的量浓度为 mol/L=0.049 4 mol/L。
答案:(1)2NO+O2===2NO2,3NO2+H2O===2HNO3+NO(叠加反应为4NO2+O2+
2H2O===4HNO3) (2)圆底烧瓶、烧杯 NO、O2、H2O (3)②水进入盛O2的储气瓶,
圆底烧瓶内气体由无色变为红棕色,由下而上完全转化 ③用手(或热毛巾等)将烧瓶
捂热
(4)硝酸溶液(或稀硝酸),0.049 4 mol·L-1
18.为了更好地观察到NO与O2的反应现象及探究“根据NO2的溶解性设计喷泉实验”,设计了如右图所示的实验装置,回答问题。
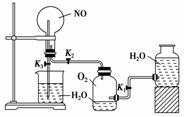
(1)该实验的原理是(用化学方程式表示)____________。
(2)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1、K2)、止水夹
(K3)、橡皮管、橡皮塞以及若干玻璃管连件外,还需的仪器______________(填仪器名
称),实验所用试剂为________________。
(3)实验步骤:
①如图连接好仪器。
②打开活塞K1和K2,主要现象为
________________________________________________________________________。
③打开止水夹K3,要使烧瓶内产生喷泉可采用的方法是
________________________________________________________________________。
④关闭活塞K1和K2。
(4)圆底烧瓶内充满了液体,该液体是________;若是溶液,假设该实验条件下Vm=
17. 已知A、B、C、D为气体,E、F ,G是氯化钙,它们之间的转换关系如下图所示:
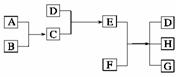
(1)D的化学式是________,E的化学式是________。
(2)A和B反应生成C的化学方程式是________________________________________________________________________。
(3)E和F反应生成D、H和G的化学方程式是________________________________________________________________________。
解析:根据→,D、C为气体,E为固体,再联系 ,且G为氯化钙,联想到实验室制NH3,E为NH4Cl,F为Ca(OH)2,则A、B、C、D、E、F、G、H依次为H2(Cl2)、Cl2(H2)、HCl、NH3、NH4Cl、Ca(OH)2、CaCl2、H2O,得到此结论,便迎刃而解。
,且G为氯化钙,联想到实验室制NH3,E为NH4Cl,F为Ca(OH)2,则A、B、C、D、E、F、G、H依次为H2(Cl2)、Cl2(H2)、HCl、NH3、NH4Cl、Ca(OH)2、CaCl2、H2O,得到此结论,便迎刃而解。
答案:(1)NH3 NH4Cl (2)H2+Cl22HCl
(3)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
16.中学化学中有很多物质可以实现如图中物质之间的转化。其中反应条件和部分反应的产物已略去。液体B和C可能是单一溶质的溶液,也可能是纯净物。
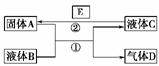
(1)若A是一种紫红色金属,气体D能使品红溶液退色,加热时又恢复原色。写出反应①的化学方程式______________________________________________。
该气体D与另一种气体H混合后生成一种淡黄色固体W,写出该反应的化学方程式________________________________________________________________________。
(2)若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液________(填“能”或“否”)。
(3)若A是一种金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色。
写出反应①的离子方程式____________________。
写出反应②的任意一个离子方程式________________________________________________________________________。
解析:本题考查物质的推断,中等题。物质的推断关键是找准突破口。(1)根据AD的描述,可以推断A为Cu ,D为SO2,故反应①为铜和浓硫酸的反应。(2)根据D的描述,可以推断D为氢气。若B为NaOH溶液,则C为Na[Al(OH)4],此时反应②不能发生,即B不能为NaOH溶液。(3)根据相关描述,A为铜,B为稀硝酸,D为NO,故反应①为铜和稀硝酸的反应,反应②为活动性比铜强的金属与硝酸铜的反应。
答案:(1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 2H2S+SO2===3S↓+2H2O (2)否
(3)3Cu+8H++2NO===3Cu2++2NO↑+4H2O Cu2++Fe===Fe2++Cu(其他合理答案也可)
15. 实验室模拟合成氨和氨催化氧化的流程如下:
→→→→
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
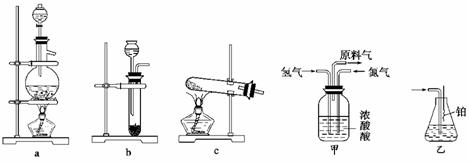
(1)从上图中选择制取气体的合适装置:氮气________、氢气____________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以______________________、__________________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,__________(“会”或“不会”)发生倒吸,原因是______________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:__________________________________,锥形瓶中还可观察到的现象是:____________________。
(5)写出乙装置中氨氧化的化学方程式:________________________________________________________________________。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、______、______离子。
解析:本题主要考查NH3的实验室制法、仪器的选择以及实验安全问题,同时也考查具体处理实验问题的能力。
(1)由题意知,制取N2应选固(液)+液加热装置a,制取氢气选简易启普发生装置。
(2)甲装置中的浓H2SO4可用于干燥气体,另外还可通过观察两导管口气泡的快慢,调节N2和H2的流速。
(3)因NH3的合成反应为可逆反应,不可能进行到底,故从合成器中出来的气体中含有大量的N2和H2,不可能发生倒吸。
(4)氨的催化氧化反应为放热反应,故可观察到铂丝保持红热,氧化生成的NO与O2反应又生成NO2,故可观察到有红棕色气体产生,生成的NO2与水反应生成HNO3,HNO3与氨水反应得到硝酸铵。
答案:(1)a b (2)干燥气体 控制氢气和氮气的流速 (3)不会 因为混合气体中含有大量难溶于水的氮气、氢气两种气体 (4)说明氨的催化氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3+5O2催化剂△4NO+6H2O (6)NH NO
14.下列离子方程式正确的是( )
A.硫酸铵溶液与氢氧化钡溶液共热:
NH+SO+Ba2++OH-BaSO4↓+NH3↑+H2O
B.氯化铵溶液中加入稀氢氧化钠:NH+OH-===NH3·H2O
C.氯化铵固体和熟石灰共热:NH+OH-NH3↑+H2O
D.碳酸铵溶液中通入足量二氧化碳:CO+CO2+H2O===HCO
解析:A项,正确的离子方程式为2NH+SO+Ba2++2OH-BaSO4↓+2NH3↑+2H2O;B项,反应原理正确,且符合离子方程式书写要求;C项,反应物均为固体,不能书写离子方程式;D项,正确的离子方程式为CO+CO2+H2O===2HCO。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com