
题目列表(包括答案和解析)
11.已知A、B、C三种元素均为短周期元素,它们的原子序数关系为C>B>A。A元素原子的最外层电子数是次外层电子数的2倍,B和C可形成BC4型化合物。用化学符号填空:
(1)三种元素中A是____________,B是____________,C是________。
(2)A、B、C的最高价氧化物对应的水化物分别是____________、_________、___________,在这些水化物中,酸性最弱的是____________。
(3)用化学方程式说明A的最高价含氧酸的酸性比B的最高价含氧酸的酸性强________________________________________________________________________;
(4)已知BC4不能在空气中燃烧,理由是___________________________________________。
(5)用离子方程式表示出用B的氧化物制得B的氧化物对应水化物的原理________________________________________________________________________。
解析:依据A的电子层结构特点,可知A为碳;B和C可形成BC4型化合物,可推知B为ⅣA族元素,C为ⅦA族元素,又因为原子序数的关系C>B>A,可知B为Si,C为氯,结合其他化合物的性质,可推知其他问题的答案。
答案:(1)C Si Cl (2)H2 CO3 H2SiO3 HClO4 H2SiO3 (3)CO2+H2O+Na2SiO3===H2SiO3↓+Na2CO3 (4)SiCl4在点燃的条件下不能被O2氧化 (5)SiO2+2OH-===SiO+H2O,SiO+CO2+H2O===H2SiO3↓+CO
10. 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HClSiHCl3+H2
③SiHCl3与过量H2在1 000-1 100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为___________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为___________________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
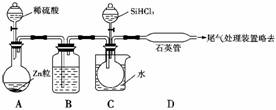
①装置B中的试剂是____________。
装置C中的烧瓶需要加热,其目的是________________________________________。
②反应一段时间后,装置D中观察到的现象是__________________________________,
装置D不能采用普通玻璃管的原因是___________________________________________,
装置D中发生反应的化学方程式为___________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________________________________________________________________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是________(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
解析:(1)根据题给信息,粗硅可以用碳还原二氧化硅的办法来制得,故反应方程式为
SiO2+2C高温,Si+2CO↑;
(2)因HCl易溶于水,而SiHCl3与H2O强烈反应,故提纯SiHCl3的方法只能在无水的条件下利用它们的沸点不同,采用分馏的方法进行;
(3)①因SiHCl3与水强烈反应,故A中产生的H2必须干燥,故B中的液体一定为浓H2SO4,且C中烧瓶需加热,其目的是使SiHCl3气化,加快与H2的反应。②根据题给信息石英管中产生的物质应为硅,故D中现象应有固体产生,由题给信息,制纯硅的反应条件为1 000-1 100℃,此温度下普通玻璃容易软化。③因高温下H2与O2容易反应而爆炸,故还应排尽装置中的空气。④铁与盐酸反应产生Fe2+,其检验方法常常采用先将Fe2+氧化为Fe3+然后再加入KSCN溶液看是否变血红色来检验。
答案:(1)SiO2+2CSi+2CO↑ (2)分馏(或蒸馏) (3)①浓硫酸 使滴入烧瓶中的SiHCl3气化 ②有固体物质生成 在反应温度下,普通玻璃会软化
SiHCl3+H2Si+3HCl ③排尽装置中的空气 ④bd或c
9. 在①浓硝酸 ②水 ③浓硫酸 ④氢氟酸 ⑤氢氧化钾溶液中,能与单质硅起化学反应的是( )
A.①② B.②④ C.④⑤ D.③④
分析:本题考查硅的化学性质,抓住硅发生的反应。
解析:硅能与F2、HF、强碱常温下反应,在加热或高温条件下也能与Cl2、O2、H2发生反应。
答案:C
8.下列说法正确的是( )
A.硅材料广泛应用于光纤通讯 B.工艺师利用盐酸刻蚀石英制作艺术品
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 D.粗硅制备单晶硅不涉及氧化还原反应
解析:B项工艺师应利用氢氟酸……;C项中水晶→SiO2;D项中粗硅制备单晶硅的反应有:Si+2Cl2SiCl4,SiCl4+2H2Si+4HCl。
答案:A
7. 中国国家航天局正式公布了嫦娥一号发回的首张月面图(下图)。月球表面的不同岩石富含硅、铝、钾、磷、铀、钍和稀土元素。下列有关月球表面富含元素的叙述正确的是( ) 
A.硅既能溶解于氢氧化钠溶液又能溶于氢碘酸
B.铝热反应中铝始终作还原剂
C.将钾投入到氯化铝溶液中,能置换出单质铝
D.磷的最高价氧化物对应的水化物为强电解质
解析:硅不能溶于HI(aq);钾投入水中与水反应会放出H2,不会置换出铝;H3PO4为中强酸,属于弱电解质。
答案:B
6. 对于化学方程式SiO2+3CSiC+2CO↑,有关叙述正确的是( )
A.反应中SiO2是氧化剂,C是还原剂
B.硅元素被还原了,碳元素被氧化了
C.在反应中C只作还原剂
D.在反应中氧化剂与还原剂的物质的量之比为1∶2
解析:双线桥法表示反应中电子转移的方向及数目如下: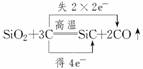 ,反应中只有C元素化合价改变,因此碳在反应中既是氧化剂,又是还原剂,且n(氧化剂)∶n(还原剂)=1∶2。
,反应中只有C元素化合价改变,因此碳在反应中既是氧化剂,又是还原剂,且n(氧化剂)∶n(还原剂)=1∶2。
答案:D
5.晶体硅和二氧化硅具有相似的晶体结构,则下列说法不正确的是( )
A.晶体硅和二氧化硅都具有较高的熔点 B.晶体硅和二氧化硅都具有较大的硬度
C.晶体硅和二氧化硅都可用作半导体材料 D.晶体硅和二氧化硅都可用于制光导纤维
分析:掌握Si和SiO2的性质和用途是解本题的关键。
解析:晶体硅和二氧化硅晶体中都只存在原子间的强相互作用,使它们具有熔点高、硬度大的性质,A、B项正确;SiO2不能用作半导体材料,C项错;晶体硅不能用于制光导纤维,D项错。
答案:CD
4.下列表述正确的是( )
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅 ②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 ③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 ④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛 ⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
解析:本题主要考查硅及其化合物的具体应用。刚玉的主要成分为Al2O3;玛瑙的主要成分是SiO2;玻璃的主要成分为SiO2和硅酸盐;水泥的主要成分为3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3等,为硅酸盐材料;Cu2O虽然是红色的,但它不能变色,也不能吸收有害光线。硅材料不会产生对环境有害的物质。
答案:D
3.下列材料的特性及用途说法错误的是( )
A.氧化铝陶瓷具有两性,不可用来制造人造牙齿
B.氮化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维导光的能力很强,是非常好的通讯材料
D.压电陶瓷十分敏感,可以将极其微弱的机械振动转换成电信号,可用来制压电地震仪
解析:对常见新型无机非金属材料的性能及用途应作了解。
特性:能耐高温、强度高,具有电学特性,光学特性,具有生物功能。
Al2O3具有两性,可与酸、碱反应,牙齿经常接触酸性物质,但氧化铝陶瓷性质相当稳定,酸碱很难将其腐蚀,且氧化铝制成的假牙与天然牙齿十分接近,选项A说法错误。
答案:A
2.(原创题)2009年夏天,台湾发生了强烈地震,地震是由于地下深处岩石破裂、错动把长期积累起来的能量急剧释放出来,以地震波的形式向四面八方传播出去,传到地面会引起房摇地动,再引起一系列的变化从而造成破坏性的自然灾害。地球的表层大多是岩石,而大多数岩石的主要成分都是硅酸盐,下面用盐或氧化物的形式表示岩石的组成,其中不正确的是( )
A.钙沸石Ca(Al2Si3O10)·3H2O表示为:CaO·Al2O3·3SiO2·3H2O
B.镁橄榄石Mg2SiO4可表示为:2MgO·SiO2
C.北京奥运会奖牌所用玉的主要成分透闪石[Ca2Mg5Si8O22(OH)2]表示为:
2CaSiO3·5MgSiO3·H2O
D.高岭石Al2(Si2O5)(OH)4可表示为:Al2O3·2SiO2·2H2O
解析:2CaSiO3·5MgSiO3·H2O中Ca与Si的原子个数比为2∶7,而Ca2Mg5Si8O22(OH)2中Ca与Si原子个数比为2∶8,故选C。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com