
题目列表(包括答案和解析)
3、将aL标准状况下氯化氢气体溶于水中制得100mL盐酸,则该盐酸的物质的量浓度为( )
A.a/22400mol/L B.a/2.24mol/L C.a/22.4mol/L D.a/11.2mol/L
2、200mL密度为1.20g/mL、质量分数为31%的硝酸的物质的量浓度为( )
A.1mol/L B.3mol/L C.6mol/L D.7.2mol/L
1、16g氢氧化钠溶于一定量水中得到200mL溶液,则该溶液的物质的量浓度为( )
A.1mol/L B.2mol/L C.3mol/L D.3.6mol/L
0.1mol 0.8mol(过量) 0.02mol(溶解量)
(1) 。
。
(2) 。
。
(3) 。
。
5注意密度变化规律
在溶液混合和溶液稀释等问题中,在注意溶液体积变化的同时,还要考虑溶液密度的变化对溶液物质的量浓度的影响。如强酸、强碱、盐等溶液的密度随浓度增大而增大;氨水、乙醇等溶液的密度随浓度增大而减小。
例5:若以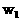 和
和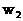 分别表示浓度为
分别表示浓度为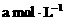 和
和 氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水小)( )
氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水小)( )
A.  B.
B.

C.  D.
D.

解析:设溶液的体积为VL,密度为 ,溶质的摩尔质量为M g·
,溶质的摩尔质量为M g· ,质量分数为w,物质的量浓度为
,质量分数为w,物质的量浓度为 。根据溶液物质的量浓度的表达方式不同,但其溶质的量不变,有V L×103 mL·
。根据溶液物质的量浓度的表达方式不同,但其溶质的量不变,有V L×103 mL· ,即
,即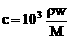 。依题意有
。依题意有 ,因2a=b,所以有
,因2a=b,所以有 ,又由于氨水的密度比纯水小,且浓度越大,密度越小,即
,又由于氨水的密度比纯水小,且浓度越大,密度越小,即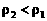 ,代入上式
,代入上式 。故答案为C项。
。故答案为C项。
6注意实验情景
在计算溶液配制或溶液稀释等问题中溶液物质的量浓度时,一要注意不能把水的体积当作溶液的体积;二是在配制溶液时,要注意容量瓶规格与实际配制溶液体积的关系。
例6:实验室需用480mL  的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是( )
A. 称取7.68g硫酸铜,加入500mL水
B. 称取12.0g胆矾配成500mL溶液
C. 称取8.0g硫酸铜,加入500mL水
D. 称取12.5g胆矾配成500mL溶液
解析:一些同学通过计算,得溶质的质量
 ,选A项;也有一些同学选C项,这里包含两个错误:一是用500mL容量瓶进行配制时,溶质的质量应满足500mL容量瓶的需求;二是错把溶剂的体积当作溶液的体积,正确情况应该是“称取8.0g硫酸铜(或12.5g胆矾),加水至500mL。”故答案为D项。
,选A项;也有一些同学选C项,这里包含两个错误:一是用500mL容量瓶进行配制时,溶质的质量应满足500mL容量瓶的需求;二是错把溶剂的体积当作溶液的体积,正确情况应该是“称取8.0g硫酸铜(或12.5g胆矾),加水至500mL。”故答案为D项。
7注意物质与其组成微粒的关系
物质与其组成微粒的物质的量、物质的量浓度之间的关系可以通过电离方程式进行分析。组成微粒的某量=对应物质的某量×物质组成中该微粒的数目。此类问题在近几年高考中出现频率较高,需引起注意。
例7:今有300mL  溶液、
溶液、 溶液和
溶液和
 溶液,这三种溶液中
溶液,这三种溶液中 的浓度之比为( )
的浓度之比为( )
A. 1:1:1 B. 3:2:1 C. 3:2:3 D. 1:1:3
解析:本题易错选A项或C项,错选A项是对物质与其组成微粒的关系把握不准造成的;错选C项是因为审题不仔细,有些同学看到浓度、体积就想到求物质的量,将题设数据分别相乘,再比较得到C项,而未细看题目要求。本题是要计算 的浓度之比,审题仔细后,很容易得到答案为D项。
的浓度之比,审题仔细后,很容易得到答案为D项。
专题训练
4.物质的量(n)微粒个数(N)和阿伏加德罗常数(NA)三者之间的关系。 阿伏加德罗常数的测定与原理
阿伏加德罗常数的符号是NA,单位是每摩(mol-1),数值是
NA =(6.0221376±0.0000036)×1023 /mol
阿伏加德罗常数由实验测定。它的测定精确度随着实验技术的发展而不断提高。测定方法有电化学当量法、布朗运动法、油滴法、X射线衍射法、黑体辐射法、光散射法等。这些方法的理论依据不同,但测定结果几乎一样,可见阿伏加德罗常数是客观存在的重要常数。例如:用含Ag+的溶液电解析出1mol的银,需要通过96485.3C(库仑)的电量。已知每个电子的电荷是1.60217733×10-19C,
物质的量浓度是关于溶液组成的一个重要物理量,是高中化学溶液有关计算的重要内容。物质的量浓度概念及表达式虽然比较简单,但不注意理解其内涵、不注意问题的特点,应用起来常常会容易出错。一般说来,要注意以下几方面的问题:
1注意溶质是什么
溶液中的溶质是什么,是运用物质的量浓度表达式进行计算时首先要考虑的,对有些特殊情况,如 、
、 等溶于水后所得溶质及氨水中溶质是什么等,要注意辨别。
等溶于水后所得溶质及氨水中溶质是什么等,要注意辨别。
例1:标准状况下,用一定量的水吸收氨气后制得物质的量浓度为 、密度为
、密度为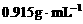 的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的相对分子质量为17.0,水的密度为
的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(本题中氨的相对分子质量为17.0,水的密度为 )
)
解析:很多同学认为氨水中的溶质为 ,导致计算出错。其实,我们习惯认为氨水中的溶质为
,导致计算出错。其实,我们习惯认为氨水中的溶质为 。设水的体积为1L,根据物质的量浓度表达式可得:
。设水的体积为1L,根据物质的量浓度表达式可得:

解得 ,故1体积水吸收378体积的氨气可制得上述氨水。
,故1体积水吸收378体积的氨气可制得上述氨水。
2注意溶液的体积
主要注意两点:一是不能用水的体积代替溶液的体积;二是当题设未给出溶液的密度时,可将各溶液(一般为稀溶液)的体积相加(如溶液混合、稀释),认为其和为溶液的总体积;当给出密度后则需通过密度进行换算求溶液的体积。
例2:在100g浓度为 、密度为
、密度为 的浓硫酸中加入一定量的水稀释成
的浓硫酸中加入一定量的水稀释成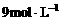 的硫酸,则加入水的体积( )
的硫酸,则加入水的体积( )
A. 小于100mL B. 等于100mL
C. 大于100mL D.
等于
解析:一些同学未考虑浓硫酸加水稀释后,溶液的密度会发生变化(减小),而直接将溶液和水的质量加和求体积。设加入水的体积为x mL,则 ,解得x=100,导致错选B项。
,解得x=100,导致错选B项。
设加入水的体积为ymL,由 得:
得:
 ,化简得
,化简得 ,即y<100。故答案为A项。
,即y<100。故答案为A项。
3注意单位运算
在概念理解及应用中,要注意各物理量的单位,一是各物理量的单位要相互匹配;二是注意从单位运算入手,能简化解题思路,快捷求解。
例3:标准状况下,1体积水大约溶解560体积氨。求:(1)所得氨水中溶质的质量分数?(2)若测得上述氨水的密度为 ,则此氨水的物质的量浓度为多少?(3)取此氨水10mL,加水稀释到1L,所得稀氨水的物质的量浓度为多少?
,则此氨水的物质的量浓度为多少?(3)取此氨水10mL,加水稀释到1L,所得稀氨水的物质的量浓度为多少?
解析:(1)注意单位量及比例关系。设取用水的体积为1L(水的质量为1000g),则溶解标准状况下氨气的体积为560L,即所得到氨水中溶质的质量分数:
 ×100%=29.8%。
×100%=29.8%。
(2)可用不同公式解答:
 。
。
(3)要注意将mL转化为L。根据公式 ,解得
,解得 。
。
4注意溶解度的影响
第一,物质的量浓度适合于表示不饱和及饱和溶液中溶质与溶剂的关系,不适合于过饱和溶液(溶质未溶解完全);第二,注意一些典型问题,如 的溶解度情况及气体物质在溶液中的溶解问题等。
的溶解度情况及气体物质在溶液中的溶解问题等。
例4:将12.6g无水亚硫酸钠固体加入100mL  的硫酸中以制取
的硫酸中以制取 气体,反应完全后,若溶液中+4价硫元素的物质的量浓度为
气体,反应完全后,若溶液中+4价硫元素的物质的量浓度为 ,假定溶液的体积不变,忽略溶液及导管中的气体体积。求:(1)溶液中硫元素的质量。(2)收集到
,假定溶液的体积不变,忽略溶液及导管中的气体体积。求:(1)溶液中硫元素的质量。(2)收集到 气体的体积。(3)溶液中
气体的体积。(3)溶液中 和
和 的物质的量浓度(不考虑弱电解质的电离)。
的物质的量浓度(不考虑弱电解质的电离)。
解析:本题涉及 气体在溶液中的溶解问题,只有
气体在溶液中的溶解问题,只有 在水中溶解量达到饱和后,才有气体逸出,因此,在计算收集到的气体体积时要减除溶解量。根据题意有以下关系量:
在水中溶解量达到饱和后,才有气体逸出,因此,在计算收集到的气体体积时要减除溶解量。根据题意有以下关系量:

3.使用范围:微观粒子
2. 阿伏加德罗常数:0.012kg12C所含的碳原子数,符号:NA,近似值6.02×1023mol-1。
1mol任何粒子含有阿伏加德罗常数个微粒。
1.摩尔:物质的量的单位。符号:mol
2.符号:n
1.意义:表示构成物质的微观粒子多少的物理量。它表示一定数目粒子的集合体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com