
题目列表(包括答案和解析)
4.解答化学平衡问题的重要思维方法 (1)可逆反应“不为零”原则 可逆性是化学平衡的前提,达到平衡时应是反应物和生成物共存的状态,每种物质的物质的量不为零。 一般可用极限分析法推断:假设反应不可逆,则最多生成产物多少,有无反应物剩余,余多少。这样的极值点是不可能达到的,故可用确定某些范围或在范围中选择合适的量。 (2)“一边倒”原则 可逆反应,在条件相同时(等温等容),若达到等同平衡,其初始状态必须能互变,从极限角度看,就是各物质的物质的量要相当。因此,可以采用“一边倒”的原则来处理以下问题:化学平衡等同条件(等温等容) aA (g)+ bB (g) cC (g) ①始 a b 0 平衡态Ⅰ ②始 0 0 c 平衡态Ⅱ ③始 x y z 平衡态Ⅲ 为了使平衡Ⅲ=Ⅱ=Ⅰ 根据“一边倒”原则,即可得 x+ z=a + =1 y+ z=b + =1 (3)“过渡态”方法 思路:各种反应物的浓度增加相同倍数,相当于增大体系压强,根据平衡移动方向来确定转化率的变化情况。
能力训练
1.外界条件对可逆反应速率的影响规律
升温,v(正)、v(逆)一般均加快,吸热反应增加的倍数大于放热反应增加的倍数;降温,v(正)、v(逆)一般均减小,吸热反应减小的倍数大于放热反应减小的倍数。加压对有气体参加的反应,v(正)、v(逆)均增大,气体体积之和大的一侧增加倍数大于气体体积之和小的一侧增加的倍数;降压,v(正)、v(逆)均减小,气体体积之和大的一侧减小的倍数大于气体体积之和小的一侧减小的倍数。增加反应物的浓度,v(正)急剧增大, v(逆)逐渐增大。加催化剂可同倍地改变v(正)、v(逆)。 思考讨论 对于合成氨反应,N2、H2的消耗速率逐渐减慢而NH3的生成速率是否逐渐加快? 答:N2、H2的消耗与NH3的生成是同一反应方向,只要N2、H2的消耗速率逐渐减慢,NH3的生成速率必然随之减慢。 2.改变条件对化学平衡的影响规律 (1)在相同温度下,对有气体参加的化学反应,压强越大,到达平衡所需的时间 越短。在相同压强下,温度越高,到达平衡所需的时间越短。 (2)平衡向正反应方向移动,生成物的物质的量增加。而生成物的浓度、生成物的质量分数以及反应物的转化率都不一定增加或提高。 (3)加催化剂,只能同倍改变正、逆反应速率,改变到达平衡所需时间,不影响化学平衡。 (4)同一反应中,未达平衡以前,同一段时间间隔内,高温时生成物含量总比低温时生成物含量大(其他条件相同)。高压时生成物的含量总比低压时生成物的含量大(其他条件相同)。 (5)在其他条件不变时,如将已达平衡的反应容器体积缩小到原来的 ,压强将大于原来的压强,但小于或等于原来压强的2倍。 3.反应物用量的改变对平衡转化率的影响规律 若反应物只有一种时,如:aA(g)b B(g)+cC(g),增加A的量,平衡向正反应方向移动,但该反应物A的转化率的变化与气体物质的计量数有关: (1)若a=b+c A的转化率不变 (2)若a>b+c A的转化率增大 (3)若a<b+c A的转化率减小 若反应物不止一种时,如:aA(g)+bB(g) cC(g)+dD(g) (1)若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。 (2)若按原比例同倍数地增加反应物A和B的量,则平衡向正反应方向移动,而反应物转化率与气体反应物计量数有关。如a+b=c+d,A、B的转化率都不变;如a+b<c+d,A、B的转化率都减小;如a+b>c+d,A、B的转化率都增大。
20.(07江苏高考)(10分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO
3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500g。
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 称取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀,静置5min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后。直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后溶液/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010mol·L-1,则该样品中氮的质量分数为 。
19.(10分) 称取含NaOH和Na2CO3的样品0.700g(杂质不与HCl反应),溶解后稀释至100mL。取20.00mL该溶液,用甲基橙作指示剂,用0.110mol/L的盐酸滴定,终点时用去26.00mL;另取20.00mL上述溶液,加入过量的BaCl2溶液,过滤,滤液中加入酚酞作指示剂,滴定达终点时,用去上述盐酸20.00mL。试求样品中NaOH和Na2CO3的质量分数。
18.现有一瓶稀氨水,要测知其中NH3·H2O的电离度,其实验方法设计如下:
(1)先测定溶液的PH,其操作过程:
;
(2)再做实验的名称是: ,目的是:
。
17.取相同体积(0.025L)的两份0.01mol/LNaOH溶液,把其中一份放在空气中一段时间后,溶液的PH (填“增大”、“减小”或“不变”),原因是
。用
已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则
(1)以甲基橙为指示剂时,VA与VB的关系是 ;
(2)以酚酞为指示剂,VA与VB的关系是 。
16.某学生中和滴定实验的过程如下: (a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)即加入待测的NaOH溶液,(d)记录液面刻度读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净的锥形瓶中,(g)加入适量蒸馏水,(h)加入酚酞试液两滴,(i)滴定时,边滴边摇荡,(j)边注视滴定管内液面的变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定,(l)记录液面刻度读数,(m)根据滴定管的两次读数得出NaOH溶液体积为22毫升.指出上述实验过程中错误之处(用编号表示)__________ _____。
14.中和相同体积,相同pH的Ba(OH)2、NaOH、和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 ( )
A.V3>V2>V1 B.V3>V2=V1 C.V3=V2>V1 D.V1=V2>V3
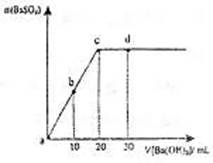 15.常温下,向0.1mol·L-1的硫酸溶液中逐滴加入
15.常温下,向0.1mol·L-1的硫酸溶液中逐滴加入
物质的量浓度相同的氢氧化钡溶液,生成沉淀的
量与加入氧氧化钡溶液的体积关系如图所示,a、
b、c、d分别表示实验时不同的阶段的溶液,下
列有关说法中不正确的是 ( )
A.溶液的pH: a < b < c < d
B.溶液的导电能力:a > b > d > c
C.a、b溶液呈酸性
D.c、d溶液呈碱性
13.(08全国Ⅱ卷)实验室现有3种酸碱指示剂,其pH的变色范围如下:
甲基橙:3.1-4.4 石蕊:5.0-8.0 酚酞:8.2-10.0
用0.1000mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是 ( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
11.下列可用于测定溶液pH且精确度最高的是
A.酸碱指示剂 B.pH计 C.精密pH试纸 D.广泛pH试纸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com