
题目列表(包括答案和解析)
1.(2009·重庆理综,6)材料与化学密切相关,表中对应关系错误的是( )
|
选项 |
材 料 |
主要化学成分 |
|
A |
刚玉、金刚石 |
三氧化二铝 |
|
B |
大理石、石灰石 |
碳酸钙 |
|
C |
普通水泥、普通玻璃 |
硅酸盐 |
|
D |
沙子、石英 |
二氧化硅 |
解析:A项,刚玉的主要化学成分为三氧化二铝,而金刚石的主要化学成分为碳。
答案:A
21.茶是我国人民喜爱的饮品。某校化学兴趣小组的同学设计以下实验来定性检验茶叶中
含有Ca、Al、Fe三种元素。
查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质。草酸钙(CaC2O4)难溶于水。Ca2+、Al3+、Fe3+完全沉淀的pH为Ca(OH)2;pH≥13;Al(OH)3:pH≥5.5;
Fe(O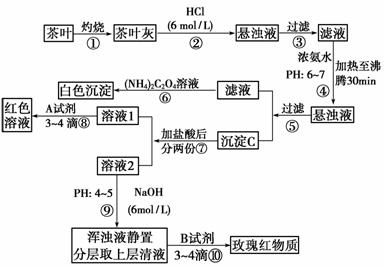 H)3:pH≥4.1。
H)3:pH≥4.1。
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是 。
(2)写出检验Ca2+的离子方程式 。
(3)写出沉淀C所含主要物质的化学式 。
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式 。
(5)步骤⑨的作用是 ,
猜测步骤⑩的目的是 。
解析:根据实验流程知第②步用盐酸把Fe3+?、Al3+?、Ca2+?从固体物质中浸出。
第③步得到含有Ca2+?、Al3+?、Fe3+?的溶液。
第④步控制pH为6~7时,Fe(OH)3、Al(OH)3完全沉淀。第⑥步生成
CaC2O4沉淀。第⑧步是利用SCN-检验Fe3+的存在。溶液2控制pH为4~5时,
Fe(OH)3完全沉淀,铝元素以Al3+形式存在。
答案:(1)使Ca2+?、Al3+?、Fe3+?溶解在盐酸中
 (2)Ca2+?+(NH4)2C2O4 CaC2O4↓+2NH+4
(2)Ca2+?+(NH4)2C2O4 CaC2O4↓+2NH+4
(3)Fe(OH)3、Al(OH)3
 (4)Fe3++3SCN-
Fe(SCN)3
(4)Fe3++3SCN-
Fe(SCN)3
(5)使Fe3+转化为Fe(OH)3沉淀
检验Al3+的存在
20.(2008·广东,21)某种催化剂为铁的氧化物。化学兴趣小组在实验室对该催化剂中铁元素
的价态进行探究:将适量稀硝酸加入少许样品中,加热溶解;取少许溶液,滴加KSCN溶
液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3价的结论。
(1)请指出该结论是否合理并说明理由 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;3 mol·L-1
H2SO4、3% H2O2、6 mol·L-1 HNO3、0.01 mol·L-1 KMnO4\,NaOH稀溶液、0.1 mol·L-1
KI、20% KSCN、蒸馏水。
①提出合理假设
假设1: ;
假设2: ;
假设3: 。
②设计实验方案证明你的假设
③实验过程
 根据②的实验方案,进行实验。请按下表格式写出实验操作步骤、预期现象与结论。
根据②的实验方案,进行实验。请按下表格式写出实验操作步骤、预期现象与结论。
解析:(1)如果催化剂中铁元素的化合价为+2价,当加入HNO3后,稀HNO3将Fe2+氧化
为Fe3+,出现同样的现象,因此结论不正确。
(2)①催化剂中铁元素存在的价态情况有:铁元素的价态全为+3价,铁元素的价态全为
+2价,铁元素的价态既有+2价又有+3价,因此可作这三种假设。②要证明只有+2价的铁
元素,可以取样品,将其溶解在已赶走溶解的O2的稀H2SO4中,然后加入KSCN,若无
血红色则证明催化剂中只有Fe2+,若出现血红色,则催化剂中只有+3价Fe或既有+2价又
有+3价的铁元素。另取溶液,加入少量KMnO4溶液,若溶液呈紫红色,则只有+3价铁
元素,若溶液紫红色褪去,则既有+2价铁,又有+3价铁存在。
答案:(1)不合理。实验设计不合理,因为硝酸会氧化催化剂中可能存在的二价铁,所以从实验结果只能判断样品溶解后的溶液中存在三价铁而不能确定样品中铁元素的价态。
(2)①催化剂中铁元素全部为+3价
催化剂中铁元素全部为+2价
 催化剂中铁元素同时存在+2价与+3价
催化剂中铁元素同时存在+2价与+3价
19.(2010·试题调研,山东济南3月)菠菜营养丰富,素有“蔬菜之王”之称,是一种高效的
补铁剂。长期以来民间流传有“菠菜不能与豆腐同食”、“菠菜根比菠菜茎叶更有营养”等
说法。某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁?
②菠菜是否含有草酸类物质?
③菠菜根中铁的含量是否比菠菜茎和叶的高?
该同学通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水。
他们设计的实验步骤如下:
 Ⅰ.
Ⅰ.
Ⅱ.取菠菜根a g使用相同仪器、试剂,重复Ⅰ中实验,观察实验现象。
Ⅲ.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液。向滤液中加入足量
Ca(OH) 2溶液,然后再加入足量试剂X,观察现象。
请回答以下问题:
(1)操作①中使用的仪器除三脚架、酒精灯、玻璃棒外还需要 ,操作
②的名称是 ;
(2)可以说明菠菜根中Fe元素含量要比菠菜茎叶中多的现象是 。
(3)菠菜中的Fe是+2价还是+3价? ;
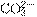 (4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质。由于滤液中含有 ,故需加入试剂
(4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质。由于滤液中含有 ,故需加入试剂
 X排除 的干扰。则X是
(写化学式),加入试剂X后观察到的现象
X排除 的干扰。则X是
(写化学式),加入试剂X后观察到的现象
是 。
解析:Fe3+与KSCN溶液作用会生成血红色络合物,红色越深,说明Fe3+含量越高。
由题给信息可知酸性:草酸>乙酸>碳酸,所以可用乙酸来除去CO2-3的干扰,加入CH3COOH
后,CaCO3可以溶解,但草酸钙不与CH3COOH反应。
答案:(1)坩埚、坩埚钳、泥三角 过滤
(2)步骤Ⅱ中得到溶液的红色比步骤Ⅰ中得到溶液的红色深
(3)+2价 (4)CH??3COOH 沉淀部分溶解
18.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
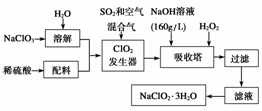
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为__________,若要计算该溶液溶质的质量分数,还需要的一个条件是_______________________________________________________。
(2)在发生器中鼓入空气的作用可能是________(填序号)。
A.将SO2氧化成SO3,增强酸性
B.稀释ClO2以防止爆炸
C.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为________________________________________________________________________,
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式:________________________________________________________________________
________________________________________________________________________。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单的实验方法是____________________________________________________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是______(填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.PbO(悬浊液)
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(填序号)
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是________(填操作名称)。
解析:(1)160 g/L NaOH溶液表示的是1 L溶液中含有NaOH的质量是160 g,NaOH的物质的量是4 mol,所以此溶液的物质的量浓度是4 mol/L,若要计算该溶液的质量分数 ,需要知道溶液的质量,所以还需要的条件是溶液的密度。
(2)根据题给信息,纯ClO2易分解爆炸,由此可判断发生器中鼓入空气的作用是稀释ClO2以防止爆炸。
(3)通过吸收塔内的反应制备NaClO2,ClO2是氧化剂,H2O2是还原剂,相应的氧化产物应是氧气,同时参加反应的还有NaOH,此反应的化学方程式应为:2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2;H2O2分解的化学方程式为2H2O22H2O+O2↑。
(4)判断NaOH是否过量可以采用测定溶液pH的方法。
(5)本实验的目的是制备纯净的亚氯酸钠(NaClO2),制备过程中选取的还原剂不能引入杂质,H2O2相应的产物是H2O和氧气,没有引入杂质。分析选项,Na2O2相应的产物是NaOH和氧气,不会引入杂质,PbO(悬浊液)相应的产物是PbO2固体,过滤可以除去。B、C都会引入杂质。
(6)从滤液中得到粗晶体的步骤是蒸发、冷却结晶和过滤,或者直接冷却结晶、过滤。由粗晶体制得纯的晶体,则需要重结晶。
答案:(1)4 mol/L 该溶液的密度 (2)B
(3)2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O2 2H2O22H2O+O2↑ (4)连续测 定吸收塔内溶液的pH (5)AD (6)BED或ED 重结晶
17. (1)在没有现成的CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置,应选用的仪器是(填入编号)________;
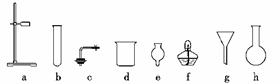
(2)若用上述发生装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,设计比较合理的方案,应选用的药品是__________。
解析:(1)本题实质是考查考生是否掌握启普发生器的反应物质,用干燥管、烧杯和单孔塞组合,可以取代启普发生器中的“球形漏斗”和“容器”这两个核心部分,从而达到随关随停的目的。
(2)选用试剂时要注意,题目没有提供学生熟悉的盐酸,而硫酸会与大理石生成CaSO4沉淀,包在其表面阻止CaCO3继续和酸作用产生CO2;块状Na2CO3遇酸会溶解,使制气装置起不到随关随停的作用,本题只能选用大理石、浓硝酸和水。
答案:(1)a、c、d、e (2)浓硝酸、水、块状大理石
16.(2008·四川理综,26)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理 由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是________________________________________________________________________。
解析:(1)根据无色溶液,可判断一定无CuSO4,因为CuSO4溶液为蓝色。
(2)根据焰色反应呈黄色,则判断一定有Na2SO4,不能确定其他的物质是否存在。
(3)与盐酸反应放出气体,且沉淀完全溶解,因此一定有MgCO3,一定无Ba(NO3)2和AgNO3,若有这两种物质,会生成不溶于盐酸的沉淀。
答案:(1)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2、 AgNO3 |
MgCO3沉淀溶于稀盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失 |
(4)Al2(SO4)3
15.有六种无色溶液,已知它们分别是Na2CO3、,Na2SO、4、NaClO、KI、BaCl2和HCl的溶
液,要求不用其他试剂把它们一一鉴别出来。为了鉴别它们各贴以标签a、b、c、d、e、f
然后进行下列实验,实验现象记录如下:
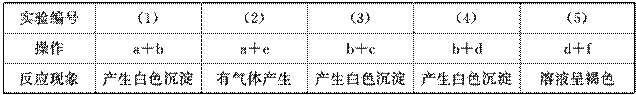
注:Ba(ClO) 2是白色沉淀,ClO-能使I-氧化。
试判断a\,b\,c\,d\,e\,f分别是:a ,b ,?c ,
D ,e , f 。(填化学式)
解析:六种物质中混合能产生褐色溶液的必定是氧化性的NaClO将KI中的I-氧化而得到
了褐色碘水,再由(4)中b与d反应产生白色沉淀可知,d是NaClO,f是KI,六种物质
中反应能产生气体的只有Na2CO3和HCl溶液,再结合(1)中a与b反应产生白色沉淀可
知,a为Na2CO3,e为HCl,进而可推知其他两种物质。
答案: Na2CO3 BaCl2 Na2SO4 NaClO HCl KI
14.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:
(1)FeH2Cu
(2)CuOCuSO4Cu
若用这两种方法制得等量的铜,则下列有关说法符合实际情况的是( )
A.消耗氧化铜的质量相同 B.消耗铁的质量相同
C.消耗硫酸的质量相同 D.生成硫酸亚铁的质量相同
解析:此题的关键问题在于实际操作中的注意事项。制备1 mol Cu需1 mol CuO,而H2还原时由于排空气、冷却,因此需要远大于1 mol H2的量,即消耗的Fe、H2SO4及生成的FeSO4均多。
答案:A
13.可用下图装置制取(必要时可加热)、净化、收集的气体是( )
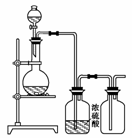
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
解析:从题给的装置看所得气体应具备下列特点:①可用浓H2SO4干燥(即不与浓H2SO4反应),②能用排空气法收集且密度比空气大(从收集装置进气管看),因此应选B。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com