
题目列表(包括答案和解析)
18.在下图所示的物质相互转化关系中,A是一种固体单质,E是一种白色不溶于水的物质。据此填空。

(1)写出各物质的化学式:
A__________、B__________、C____________、D________、E________、F________。
(2)B与a溶液反应的离子方程式是________________________________________________
________________________________________________________________________。
(3)A与a溶液反应的离子方程式是_______________________________________________。
解析:本题“突破口”是C中加入过量HCl产生不溶于盐酸的白色沉淀,推知E可能是硅酸。A可能是Si,代入题目验证,B为SiO2,能和Si和SiO2反应的溶液可能为HF溶液或NaOH溶液,结合题目知a溶液为NaOH溶液,C为Na2SiO3,D为H2O,F为H2。
答案:(1)Si SiO2 Na2SiO3 H2O H2SiO3 H2 (2)SiO2+2OH-===SiO+H2O
(3)Si+2OH-+H2O===SiO+2H2↑
17. (2008·广东,23)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
焦炭高温HCl573 K以上H21 357 K
①写出由纯SiHCl3制备高纯硅的化学反应方程式___________________________________
________________________________________________________________________。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________________________;
H2还原SiHCl3过程中若混入O2,可能引起的后果是______________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释__________________________________________________。
解析:(1)①根据原子守恒即质量守恒可以写出SiHCl3与H2反应的化学方程式。
②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知 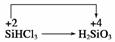 ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
(2)碳化硅、氮化硅为原子晶体,则A、B、C都正确;D中玻璃没有固定的熔点,盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应。因此E不正确。
答案:(1)①SiHCl3+H2Si+3HCl ②SiHCl3+3H2O===H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3 (2)ABC (3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成 解释:Na2SiO3和NH4Cl均能够水解,二者相互促进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3
16.如下图所示。已知单质I可作为半导体材料,单质G是密度最小的气体,化合物H是无色无味的有毒气体,能在空气中燃烧,化合物E极易溶于水形成无氧酸,该无氧酸在常温时能够与氧化物A起反应。

请填空:
(1)氧化物A的化学式是________________。
(2)化合物E的化学式是____________________。
(3)反应①的化学方程式是___________________________________________
________________________________________________________________________。
(4)反应④的化学方程式是___________________________________________________。
解析:本题属“框图”题型。要求在全面系统地掌握元素及其化合物性质的基础上,抓住某些物质的特殊性,以此作为“切入点”,找到解题的突破口。本题所给条件单质I是半导体材料,H是有毒的无色无味的气体,能在空气中燃烧,可初步得出I为Si,H为CO,A为SiO2,再根据E的性质,判断出E为HF,G为H2,F为O2等。
答案:(1)SiO2 (2)HF (3)SiO2+2CSi+2CO↑ (4)2F2+2H2O===4HF+O2
15. 为测定大理石中碳酸钙的纯度(设含杂质SiO2),某兴趣小组设计了如下几个方案:
方案Ⅰ 按下图连接好装置开始实验,通过测定装置E反应前后的质量,计算纯度。

(1)B中发生反应的离子方程式为_________________________________________________。
(2)装置C中所装的试剂是________,F的作用是___________________________________。
(3)当样品充分反应完后,缓慢通入空气的目的是:_________________________________
________________,A中所装的试剂是__________________________________________。
方案Ⅱ①称取碳酸钙样品m g ②将样品充分高温煅烧,冷却后称量,剩余固体质量为m1 g。
(4)该方案中高温煅烧应选用的仪器名称是________;判断碳酸钙样品完全分解的方法是________________________________________________________________________;
“冷却”应如何操作__________________________________________________________,
理由是_______________________________________________________________________。
(5)有同学认为方案Ⅱ高温煅烧的过程中会发生CaCO3+SiO2CaSiO3+CO2↑,会导致测定结果有误,你认为这位同学的观点正确吗?____________(填“正确”或“错误”);请说明自己的理由:__________________________________________________________。
解析:方案Ⅰ的原理是大理石与盐酸反应产生CO2,通过CO2的质量可测得大理石中CaCO3的质量。但实验过程中要注意:一是要用空气将产生的CO2全部排出,空气要事先经过NaOH溶液处理;二是生成的CO2要先除HCl,再干燥;三是防止外界空气中的H2O和CO2进入装置影响结果的测定。方案Ⅱ的原理是将大理石样品在坩埚中分解,通过计算产生CO2的量求得CaCO3的质量,尽管在煅烧过程中可能发生反应CaCO3+SiO2CaSiO3+CO2↑,但不影响CaCO3产生CO2的量,故无影响。但要注意冷却一定要在干燥器中进行,以防CaO在冷却时吸收空气中的水和CO2。
答案:(1)CaCO3+2H+===Ca2++H2O+CO2↑ (2)饱和NaHCO3溶液 防止空气中的H2O和CO2进入E中影响测定结果 (3)将装置中的残留的CO2全部赶进E中被完全吸收 NaOH溶液 (4)坩埚 样品连续两次高温煅烧,冷却称量质量相差0.1 g以内 在干燥器中冷却 防止CaO冷却的时候吸收空气中的水和CO2 (5)错误 无论是否发生该反应,生成的CO2的量一定,由C守衡计算出CaCO3的质量一定
14.氮化碳结构如下图所示,其硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是( )

A.氮化碳属于原子晶体
B.氮化碳中碳显-4价,氮显+3价
C.氮化碳的化学式为C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
解析:氮化碳硬度超过金刚石晶体,说明它属于原子晶体;碳氮原子间以共价键结合,由于氮原子的得电子能力大于碳原子,共用电子对偏向氮原子而使其显负价,根据最外层电子数可得碳显+4价,氮显-3价,据此也可得出其化学式为C3N4。由题图分析得每一个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连。
答案:B
13. 2008年9月25,“神舟七号”飞船上天了,又一次显示出我国航天技术已进入世界一流。飞船应用了许多尖端的合成材料。据报道我国科学家近年来研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的。下列相关叙述不正确的是( )
A.它耐高温抗氧化 B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点 D.它是一种新型无机非金属材料
思路点拨:解题要点就是根据物质的性能确定其用途或根据其用途推知其性能。
解析:航空材料的特点是质轻、高强度、耐高温抗氧化等高可靠性,故B错,A正确;复合材料属于混合物,没有固定的熔点,碳化硅、陶瓷和碳纤维复合而成的材料均属于新型无机非金属材料,C、D正确。
答案:B
12.金属陶瓷是一种应用于高科技的复合材料,合成方法是将陶瓷(主要成分为Al2O3、ZrO2等耐高温材料)和粘结金属(主要是Cr、Mo、W、Ti等高熔点金属)研磨混匀成型后,高温烧结使金属仍然以单质的形式存在于金属陶瓷之中,据此判断合成工艺必须( )
A.在氧气中合成 B.在HCl气氛中合成 C.在氮气气氛中合成 D.在空气中合成
解析:要金属以单质存在于陶瓷中,金属不能与O2、HCl等发生反应。
答案:C
11.下列溶液可以盛放在玻璃试剂瓶中但不能用磨口玻璃塞的是( )
A.稀盐酸溶液 B.氢氟酸 C.氢氧化钠溶液 D.氯化钠溶液
解析:C项中溶液呈碱性,不能与光滑的玻璃反应,但能与毛玻璃裸露的SiO2反应;氢氟酸能腐蚀玻璃。
答案:C
10.制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现:
①Si(s)+3HCl(g)SiHCl3(g)+H2(g);ΔH=-381 kJ·mol-1
②SiHCl3+H2Si+3HCl
对上述两个反应的叙述中,错误的是( )
A.两个反应都是置换反应 B.反应②是吸热反应
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
解析:①②是逆向进行的反应,①放热反应,②必然是吸热反应,①②进行条件不一样,不能称为可逆反应。
答案:C
9. 硅酸铜钡是当今最新科学技术合成的一种物质,然而科学家惊奇地发现,我国秦朝兵马俑用的一种颜料也是硅酸铜钡。由以上事实推测,下列关于硅酸铜钡的说法错误的是( )
A.易溶于水 B.难溶于水 C.属于硅酸盐 D.含有两种金属阳离子
解析:硅酸铜钡属于硅酸盐,含有Cu2+和Ba2+两种金属阳离子。硅酸盐除了钾盐、钠盐一般都不溶于水,而且作为一种颜料,也应该不溶于水。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com