
题目列表(包括答案和解析)
8. 在一定温度下,将一定质量的混合气体在密闭容器中发生反应aA(g)+bB(g)  cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6
mol/L,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4
mol/L,下列叙述中正确的是( )
cC(g)+dD(g),达到平衡时测得B气体的浓度为0.6
mol/L,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4
mol/L,下列叙述中正确的是( )
A.a+b>c+d B.平衡向右移动
C.重新达平衡时,A气体浓度增大 D.重新达平衡时,D的体积分数减小
解析:本题考查平衡移动规律以及浓度概念等知识,同时考查综合分析问题和解决问题的能力以及逆向思维能力。在恒温下密闭容器的容积扩大1倍,则容器的各种气体物质的量浓度各减半,此刻B气体的浓度应为0.3 mol/L,但其实际浓度为0.4 mol/L,说明当容器容积扩大一倍,相当于压强减小化学平衡向气体体积增大的方向移动,B气体的浓度由0.3 mol/L增加到0.4 mol/L,所以化学计量数关系为:a+b>c+d,即减小气体压强,平衡向气体体积增大的方向移动。
由于在容积扩大一倍时,A气体的浓度将减小,故C项不符合题意。
选项D中,由于平衡向逆反应方向移动,D气体的物质的量减小,所以其体积分数也减小。
答案:AD
7. 把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示,在下列因素中,影响O-t1时间段反应速率的主要因素是( )

A.盐酸的浓度 B.镁条的表面积
C.Cl-的浓度 D.溶液的温度
解析:镁条和盐酸反应的实质为:Mg+2H+===Mg2++H2↑,O-t2过程中,c(H+)、镁条的表面积一直减小,而O-t1过程中,反应速率一直加快,故O-t1时间段影响速率的主要因素为温度,即反应放热引起溶液温度的升高;t1-t2时间段影响速率的主要因素为c(H+)。
答案:D
6.
在V
L密闭容器中,通入0.2 mol SO2和0.2
mol SO3气体,在一定条件下,发生可逆反应:2SO2+O2 2SO3,平衡时SO3为a
mol,在相同温度下分别按下列配比在V L密闭容器中放入起始物质,平衡时有关SO3的物质的量叙述正确的是( )
2SO3,平衡时SO3为a
mol,在相同温度下分别按下列配比在V L密闭容器中放入起始物质,平衡时有关SO3的物质的量叙述正确的是( )
A.放入0.3 mol SO2、0.1 mol O2、0.1 mol SO3,达到平衡时SO3必小于a mol
B.放入0.2 mol SO2、0.1 mol O2、0.2 mol SO3,达到平衡时SO3必小于a mol
C.放入0.4 mol SO2、0.1 mol O2,达到平衡时SO3必等于0.4 mol
D.放入0.2 mol SO2、0.1 mol O2,达到平衡时SO3必小于a mol
解析:根据等效平衡,题干中0.2 mol SO2和0.2 mol SO3相当于0.4 mol SO2和0.1 mol O2。与之相比较:A选项相当于0.4 mol SO2和0.15 mol O2,所以SO3大于a mol;B选项相当于0.4 mol SO2和0.2 mol O2,所以SO3大于a mol;C选项平衡时SO3等于a mol;D选项平衡时SO3小于a mol。
答案:D
5. 在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
思路分析:题目中可以应用的信息主要有:①SO2和O2反应生成SO3,ΔH<0,且体积缩小,②两个v-t图像和α(SO2)-t的关系图像,本着外界因素对化学反应速率的影响规律分析引起变化的因素。
解析:这是一道把图像、反应速率的影响因素等结合在一起的逆向考查综合题。
图Ⅰ中t0时刻的v′(正)、v′(逆)都高于原平衡化学反应速率且v′(正)>v′(逆),应是增大体系的压强所致,A项错;图Ⅱ中图像显示v′(正)=v′(逆)都高于原平衡体系,而体系中通入氦气只能增大体系的总压,并未改变各组分的分压,故不影响v′(正)、v′(逆),B项错;催化剂只能改变化学反应速率,对化学平衡无影响,因而加入催化剂后,甲、乙能达到同一平衡状态,C项错;图Ⅲ中乙比甲到达平衡所需时间短,其他条件不变时,T(乙)>T(甲),且此反应是ΔH<0,温度由T(乙)―→T(甲)降低,α(SO2)降低,符合曲线变化,D项正确。
答案:D
4.如下图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加其他任何物质,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
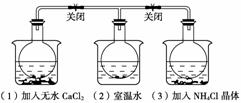
A.CaCl2溶于水时放出热量
B.烧瓶(1)中气体的压强不变
C.NH4Cl溶于水时放出热量
D.烧瓶(3)中气体的压强增大
解析:三个烧瓶中都存在如下平衡:2NO2(g)  N2O4(g);ΔH<0,(1)中红棕色变深,平衡左移,所以CaCl2溶于水放热,(3)中变浅,平衡右移,说明NH4Cl溶于水时吸热
N2O4(g);ΔH<0,(1)中红棕色变深,平衡左移,所以CaCl2溶于水放热,(3)中变浅,平衡右移,说明NH4Cl溶于水时吸热
答案:A
3.一定条件下,在可变容积的密闭容器中进行下列可逆反应:
S2Cl2(l)+Cl2(g)  2SCl2(l);ΔH=-51.16
kJ·mol-1
2SCl2(l);ΔH=-51.16
kJ·mol-1
浅黄色 鲜红色
下列说法正确的是( )
A.达到平衡时,抽出少量氯气,反应混合液颜色变深
B.单位时间内生成2n mol S2Cl2,同时生成n mol SCl2时,平衡向逆反应方向移动
C.达平衡时,降低温度,混合液的颜色将变浅
D.单位时间内有n mol Cl2被还原,同时氧化生成n mol Cl2时,平衡向正反应方向移动
解析:抽出Cl2,平衡不移动,混合液颜色不变,A项错误;B项正确;降温,平衡正移,混合液颜色变深,C项错误;n mol Cl2被还原,同时n mol Cl2被氧化,即v正=v逆,平衡不移动,故D项错误。
答案:B
2.
(2008·全国理综 Ⅰ,11)已知:4NH3(g)+5O2(g)  4NO(g)+6H2O(g);ΔH=-1
025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g);ΔH=-1
025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
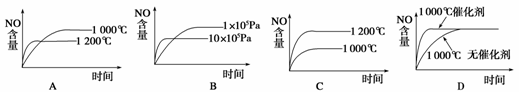
解析:由于该反应为放热反应,升高温度平衡左移,NO的含量降低,因此A正确、C错;又由于该反应为气体体积增大的反应,增大压强平衡左移,因此压强越大,NO的含量越低,故B正确;而催化剂只能提高反应速率,不会引起平衡的移动,因此D正确。
答案:C
1.已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是( )
①生成物的质量分数一定增加 ②生成物产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥一定使用催化剂A.①②③ B.③④⑤ C.②⑤ D.④⑥
解析:当增加某反应物的浓度平衡正向移动,生成物的质量分数可能减小,该反应物的浓度增大;当多种物质作反应物时增加一种反应物浓度,平衡正向移动,该反应物的转化率降低,其余反应物的转化率增大;使用催化剂不改变化学平衡移动的方向。
答案:C
11.反应2A(g)+B(g)  3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。
3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。
求:(1)A、B的转化率分别为:αA=________,αB=________。
(2)平衡混合气体的平均相对分子质量(设A的相对分子质量为MA,B的相对分子质量为MB):__________。
(3)平衡时压强与起始相比,有何变化?________(填“增大”“不变”或“减小”)。
解析:(1)2A(g)+B(g)  3C(g)
3C(g)
起始量 5 2 0
变化量 2x x 3x
平衡量 5-2x 2-x 3x
由已知得×100%=60% x=1.4,所以αA=×100%=56%
αB=×100%=70%。
(2)总质量、总体积保持不变,则恒温下,平衡后的混合气体平均相对分子质量即为A、B两气体混合时的平均相对分子质量。
(3)反应2A(g)+B(g)3C(g)中两边气体总系数相等,反应前后气体的总的物质的量不变,则在恒温恒容条件下,压强不变。
答案:(1)56% 70% (2)= (3)不变
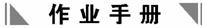
10.将各2a mol的P、Q、R、S在一密闭容器中混合,发生如下反应:xP+yQ zR+wS。达到平衡后,测得n(P)=a
mol,n(Q)=
mol,n(R)=
mol,n(S)=3a
mol,已知四种物质中只有R是固体。
zR+wS。达到平衡后,测得n(P)=a
mol,n(Q)=
mol,n(R)=
mol,n(S)=3a
mol,已知四种物质中只有R是固体。
(1)若该反应中物质的化学计量数x=2,则z=________,w=________。
(2)达到平衡时,P的转化率是____________。
(3)如果只改变压强,化学反应速率发生变化,但化学平衡不移动。则该反应中各物质的聚集状态分别是:Q____________,S____________。
(4)如果只升高温度,反应一段时间后,各物质的物质的量均变为2a mol,则该反应的正反应为________热反应。
解析:(1)xP+yQ zR + wS
zR + wS
始/mol: 2a 2a 2a 2a
平/mol: a a a 3a
变/mol: a a a
x∶y∶z∶w=a∶∶a∶a=2∶1∶3∶2,由x=2得z=3,w=2。
(2)P的转化率为×100%=50%。
(3)若改变压强,化学反应速率发生变化,但化学平衡不移动,则该反应为气体体积不变的反应。Q为液态(因已知只有R为固态,故Q不能为固态),S为气态。
(4)由题设条件可推知,升温平衡向逆反应方向移动,因此正反应为放热反应。
答案:(1)3 2 (2)50% (3)液态 气态 (4)放
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com